23.01.2024

16 января 2024 года в Journal of Clinical Oncology были опубликованы результаты долговременного, заранее спланированного анализа выживаемости пациентов в исследовании CLEAR – открытого рандомизированного исследования 3 фазы, в котором сравнивались два лечебных подхода у пациентов с распространенным почечноклеточным раком, ранее не получавших какую-либо системную терапию [1,2]. Напомним: пациенты были рандомизированы (1:1:1) для приема ленватиниба (20 мг в день перорально, 21-дневные циклы) плюс пембролизумаб (200 мг внутривенно каждые 21 день; группа ленватиниба и пембролизумаба), ленватиниба (18 мг в день перорально) плюс эверолимус (5 мг в день перорально; группа ленватиниба плюс эверолимус) в 21-дневных циклах или сунитиниб (50 мг в день перорально, 4 недели приема и 2 недели перерыва; группа сунитиниба). На момент публикации в апреле 2023 года комбинация ленватиниба и пембролизумаба была признана наиболее эффективной и рекомендованной для 1 линии терапии подобных больных.
На первый и незамутненный взгляд – результаты говорили сами за себя, об этом свидетельствовало расхождение кривых выживаемости без прогрессирования: медиана ВБП при применении сунитиниба в монорежиме составила 9,2 мес. (95% ДИ 6,0-11,0), тогда как комбинация показала значимое преимущество – 23,3 мес. (95% ДИ 20,8-27,7). И, разумеется, на любом пленарном заседании количество точек лазерной указки, помещающихся между кривыми, и дальше вызывало бы восторг у коллег. Однако восторгаться, к сожалению, пока поводов мало, так как данные по общей выживаемости требуют детального разбора.
По результатам оценки выживаемости медиана в группе сунитиниба составила 53,4 мес. (95% ДИ 40,9-NE) против 53,7 мес. (95% ДИ 48,7-NE), а кривые выживаемости (как можно видеть на графике, рис.1) слились воедино уже на 4 году наблюдения, в том числе и при отдельном, ранее не запланированном анализе групп промежуточного и плохого прогноза по IMDC – что позволяет сделать однозначный вывод: назначение комбинированного лечения не делает жизнь большинства наших пациентов с метастатическим раком почки дольше и лучше.
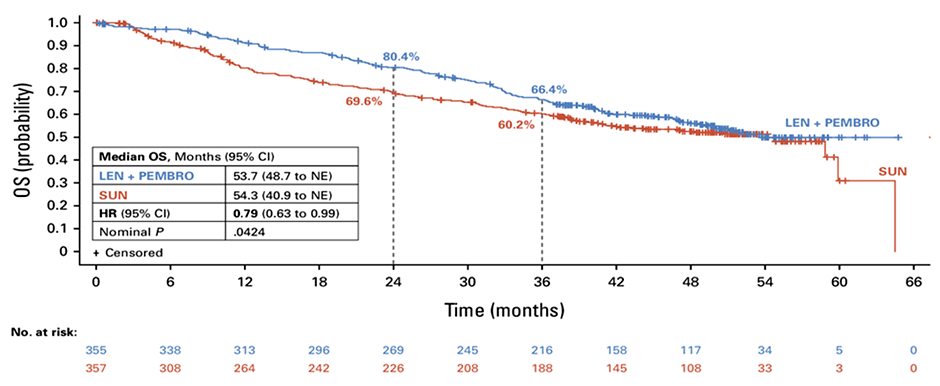
Рисунок 1. Кривые общей выживаемости в исследовании CLEAR [2].
Однако следует признать целесообразность назначения комбинированного лечения при заболевании высокого риска по IMDC, значимом и симптомном распространении, требующем объективного и быстрого ответа на проводимую терапию. В частности, по 5-летним результатам исследования CLEAR [2] частота объективного ответа в группе сунитиниба в два раза меньше, чем в группе комбинации пембролизумаб + ленватиниб (36,7% против 71,3%, ОР 1,94), хотя не стоит забывать и о большей токсичности комбинации, которая может стать условным препятствием в реализации ответа.
Но почему оказалось так, что комбинация не продлевает жизнь?
В исследовании CLEAR комбинация ленватиниба и пембролизумаба применялась для лечения метастатического рака почки любой степени риска по шкале IMDC. Однако на основании этой и других работ проводились метаанализы для оценки роли комбинированного лечения в группе благоприятного риска. В частности, в метаанализе испанских авторов [3] было продемонстрировано полное отсутствие выигрыша в общей выживаемости (HR=0,99; 95% ДИ 0,69-1,43). Возможно, отчасти за счет пациентов группы благоприятного риска в исследовании CLEAR результаты несколько «размываются», так как исходно эти пациенты не могут выиграть от комбинированной терапии и влияют на общую кривую выживаемости. Напомню, что таковых пациентов было ≈30% в каждой группе.
Также можно предположить, что дело и в последующих линиях терапии, которые могли повлиять на кривые выживаемости. Тем не менее, в приложении к статье указано, что только 68,7% пациентов получили последующую линию терапии после сунитиниба, из них 45,4% пациентов получили другой TKI ингибитор, и лишь 54,6% пациентов познакомились с иммунотерапией. Таким образом, маловероятно, что это могло значимо исказить результаты исследования, более того, это говорит о некоторой ущемленности рукава пациентов, получавших сунитиниб. В систематическом анализе Vinay Prasad и соваторов [4], включившем в том числе и исследование CLEAR, было продемонстрировано (рис.2), что выигрыш от применения иммунотерапии иногда усиливается за счет плохой терапии после прогрессирования пациентов, включенных в протокол.
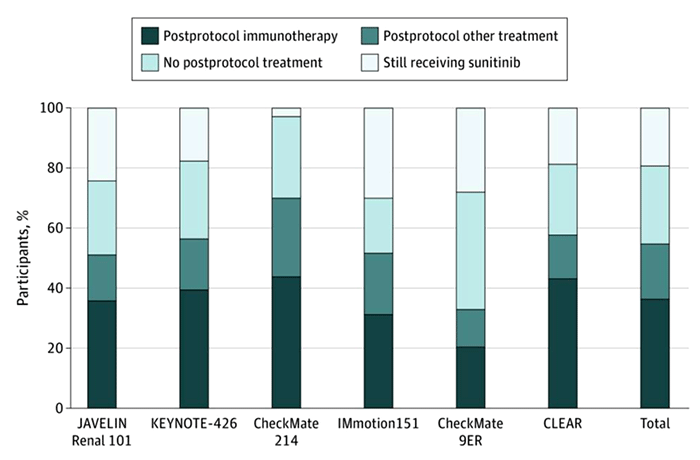
Рисунок 2. Доли пациентов, получавших различные режимы лечения после прогрессирования на сунитинибе в различных клинических исследованиях.
Таким образом, несмотря на кажущуюся очевидность преимущества комбинированной иммунотаргетной терапии в лечении метастатического рака почки, необходимо учитывать, что выживаемость не всегда улучшается за счет «наилучшего лечения». Учитывая фармако-экономические критерии и токсичность, не будет ошибкой применять монотерапию сунитинибом у пациентов благоприятного риска по IMDC или у пациентов с небольшим объемом заболевания и отсутствием симптомов, требующих быстрого объективного ответа.
Источники: