Новости онкологии Уголок радиотерапевта
16.01.2024

Первое, что приходит в голову при упоминании показаний к адъювантной терапии при раке тела матки, – ну, опять старая песня! Действительно, вопрос поднимался на протяжении последних лет неоднократно, проведены и опубликованы три крупных исследования PORTEC, и все же, несмотря на социальную значимость данной нозологии и почетное четвертое место в структуре женской онкологической заболеваемости, показания носят расплывчатый рекомендательный характер, особенно при первой стадии заболевания, и проблема до сих пор не решена. На протяжении последних двадцати лет мы прошли долгий путь от адъювантной лучевой терапии на весь малый таз при малейших признаках инвазии в миометрий, даже при эндометриоидных аденокарциномах grade 1-2, до полного отсутствия адъювантного лечения при ранних высокодифференцированных типичных раках, альтернативой которому является короткий курс брахитерапии на культю влагалища, и сложного тяжелого химиолучевого лечения при подтвержденной III стадии заболевания. При этом, если с местнораспространенными формами все более-менее ясно, то с ранними формами рака эндометрия четкие критерии выбора между опциями наблюдение/брахитерапия – отсутствуют. Многие радиотерапевты сталкиваются с ситуациями, когда хирурги, с разрешения консилиума отпустившие под наблюдение своих больных с неглубокой инвазией, выявляют на протяжении первого года наблюдения рецидивы в культе влагалища и приводят новых своих больных за руку в отделение радиологии с просьбой – давайте все-таки облучим профилактически! Радиотерапевты, не имея четких критериев отбора, соглашаются или отказывают в лечении – и, как правило, и то, и другое без должной мотивации.
Итак, в двух словах, об опорных критериях, валидированных на сегодняшний день и отраженных в стадировании или в группах риска:
Если взглянуть на прогностические группы, сформированные на базе вышеозначенных критериев, а также на клинические рекомендации Минздрава РФ, мы увидим, что предлагаемая тактика лечения допускает массу девиаций, а в 6 из 10 граф «лечение» фигурирует союз «или» либо любимый нами (и рекомендациями NCCN) символ «±».
Таблица 1. Группы риска при РТМ (консенсус ESGO, ESMO, ESTRO, 2014).
| Риск | Описание |
|---|---|
| Низкий | Эндометриальный РТМ, стадия |
| Промежуточный | Эндометриальный РТМ, стадия |
| Промежуточно-высокий | Эндометриальный РТМ |
| Стадия IA, G3 | |
| Стадия IA и IB, G1-2, опухолевые эмболы в лимфатических щелях | |
| Высокий | Эндометриальный РТМ, стадия |
| Эндометриальный РТМ, стадия | |
| Неэндометриальный РТМ, любая стадия |
Таблица 2. Адъювантное лечение эндометриального РТМ I стадии (консенсус ESGO, ESMO, ESTRO, 2014).
| Риск | Лимфодиссекция выполнена, метастазов в лимфатических узлах нет | Лимфодиссекция не выполнена |
|---|---|---|
| Низкий | Нет | |
| Промежуточный | Брахитерапия или наблюдение, особенно у пациенток в возрасте <60 лет | |
| Промежуточно-высокий | Брахитерапия или наблюдение | Дистанционное облучение малого таза при опухолевых эмболах, брахитерапия при G3 |
| Высокий | Брахитерапия или дистанционное облучение малого таза | Дистанционное облучение малого таза |
Таблица 3. Адъювантное лечение эндометриального РТМ II стадии (консенсус ESGO, ESMO, ESTRO, 2014).
| Риск | Лимфодиссекция выполнена, метастазов в лимфатических узлах нет | Лимфодиссекция не выполнена |
|---|---|---|
| G1-2, нет опухолевых эмболов | Брахитерапия | Дистанционное облучение малого таза ± брахитерапия |
| G3, опухолевые эмболы | Дистанционное облучение малого таза ± брахитерапия | Дистанционное облучение малого таза ± брахитерапия |
Что мы можем добавить, чтобы сделать показания к адъювантному лечению более ясными?
Например, возраст. Достаточно давно известно, что рак эндометрия – та редкая нозология, которая у пожилых течет более злокачественно, чем у молодых, однако на сегодняшний момент в группах прогноза это не отражено. Тем не менее, по данным американских авторов, 5-летняя выживаемость у молодых пациенток до 50 лет составляет 94-96%, а в диапазоне 71-80 лет – всего 71% [2].
Однако сомнительно, может ли возраст больной служить самостоятельным прогностическим фактором. Известно, что среди больных старше 65 лет чаще встречается глубокая инвазия в миометрий, низкая степень дифференцировки и местнораспространенные процессы. Кроме того, отказ в силу возраста от максимально агрессивного лечения также может сделать свой вклад в ухудшение онкологического прогноза [3]. Тем не менее, установлено, что при условии одинакового лечения рецидивы у пожилых больных встречаются чаще, а выживаемость среди них ниже.
Вовлечение нижнего сегмента матки, по данным некоторых авторов, также служит фактором неблагоприятного прогноза [4-6], однако его самостоятельное значение также находится под сомнением, так как может отражать всего лишь более высокий риск метастазирования в регионарные лимфоузлы и, соответственно, более высокую вероятность скрытой III стадии болезни.
Так или иначе, все вышеупомянутые факторы довольно давно известны и изучены. Наиболее новый, сложный и, с моей точки зрения, интересный инструмент уточнения прогноза болезни – это генетический портрет опухоли. На сегодняшний день выделяют следующие молекулярные подтипы рака эндометрия [7-25]:
Известно, что молекулярные подтипы определяют не только прогноз заболевания, но и чувствительность его к адъювантной терапии. Так, подтип POLEmut характеризуется высокой безрецидивной выживаемостью вне зависимости от наличия или отсутствия адъювантного лечения. Аналогично, назначение лучевой терапии в любом варианте (как брахи-, так и дистанционной на весь таз) не ведет к улучшению локального контроля в случаях подтипа дефектной системы репарации неспаренных оснований (dMMR). Однако облучение всего малого таза существенно повышает безрецидивную выживаемость в случаях р53-мутированного рака эндометрия (5-летний показатель локального контроля – 97% в группе ДЛТ против 64% в группе брахитерапии и 72% в группе динамического наблюдения).
В группе без определенного молекулярного профиля (NSMP) любой вариант адъювантной лучевой терапии ведет к улучшению локального контроля (98% в группе ДЛТ и 96% в группе брахитерапии против 88% в группе динамического наблюдения).
Казалось бы, замечательно: у нас в руках появился новый мощный инструмент для определения тактики лечения рака эндометрия, и возможно, в ближайшем будущем тактика лечения будет строго регламентирована весьма конкретными клиническими сценариями, не допускающими девиаций и союзов «или» в клинических рекомендациях. Однако не все так просто. Оказалось, что в ряде случаев молекулярные подтипы опухоли и их предполагаемое биологическое поведение вступают в противоречие с известными нам факторами прогноза.
Так, POLE мутированные опухоли, составляющие всего 7-9% от общего числа случаев РТМ, несмотря на благоприятный прогноз и 96% пятилетней выживаемости, часто характеризуются низкой дифференцировкой и лимфоваскулярной инвазией, что не мешает некоторым авторам рекомендовать отказ от адъювантного лечения при доказанной мутации. По результатам метаанализа случаев РТМ с известной мутацией гена POLE, проведение любой адъювантной терапии не связано с улучшением прогноза, что приводит к мысли о деэскалации лечения в таких случаях.
В настоящее время два исследования оценивают возможность обоснованного отказа от адъювантной терапии в случае рака эндометрия: это PORTEC 4a (больные высокого промежуточного риска) [26,27] и исследование RAINBO Blue and TAPER (Tailored Adjuvant Therapy in POLE-mutated and p53-wildtype/no specific molecular profile (NSMP) Early Stage Endometrial Cancer [28,29]).
Подтип дефектной системы репарации неспаренных оснований, или dMMR мутированные опухоли (26-30% всех случаев РТМ), ведут себя более последовательно: имея промежуточный прогноз, часто характеризуются лимфоваскулярной инвазией и низкой степенью дифференцировки. Опухоли без определенного молекулярного портрета (NSMP опухоли), составляющие до 45-50% всех случаев РТМ, характеризуются разнообразной морфологической картиной, от низкой до высокой степени дифференцировки, и чаще относятся к промежуточно-благоприятному прогнозу. И, наконец, наиболее определенный и очевидно плохой прогноз имеют опухоли с мутацией гена белка p53 – «стража генома», что коррелирует у них с клинической и морфологической картиной: это в большинстве случаев рак эндометрия второго типа, встречающийся у худых женщин, часто в возрасте, как правило диагностируемый в распространенной стадии, с признаками лимфоваскулярной инвазии, низкой степени дифференцировки, преимущественно серозный рак, однако до 25% его составляют эндометриоидные аденокарциномы G3 [7-25].
В декабре 2023 года в журнале Practical Radiation Oncology опубликованы дополнения к рекомендациям по лечению раннего рака эндометрия от экспертов ASTRO. Американские авторы попытались суммировать все вышеперечисленные факторы и смодифицировать показания к адъювантному лечению, принимая во внимание возраст, молекулярный портрет опухоли и ее размер (рис.2) [30]. Если мы сравним алгоритм, предлагаемый для выбора тактики лечения до настоящего времени (рис.1), и вновь разработанный алгоритм (рис.2), мы поймем, что частично возвращаемся к хорошо забытому старому – дистанционной лучевой терапии на малый таз даже при клинически I-II стадии, если необходимость диктует, например, наличие мутации р53. При этом авторы были осторожны и не стали рекомендовать отказ от адъюванта в случае лимфоваскулярной инвазии и глубокого прорастания в миометрий даже при наличии мутации POLE. Насколько правильны эти изменения?
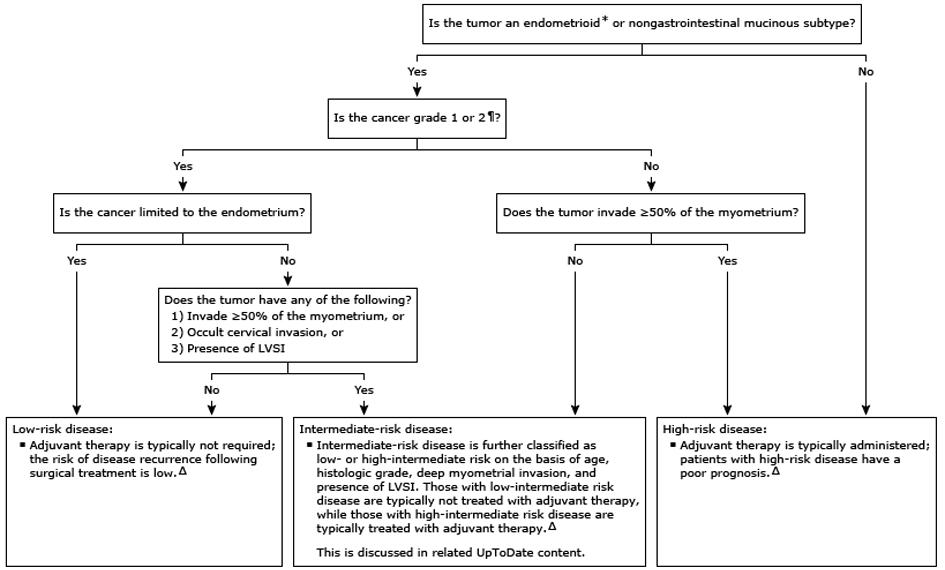
Рисунок 1. Стратификация раннего рака эндометрия в соответствии с факторами риска после оперативного лечения (UoToDate Dec 2023; www.uptodate.com/
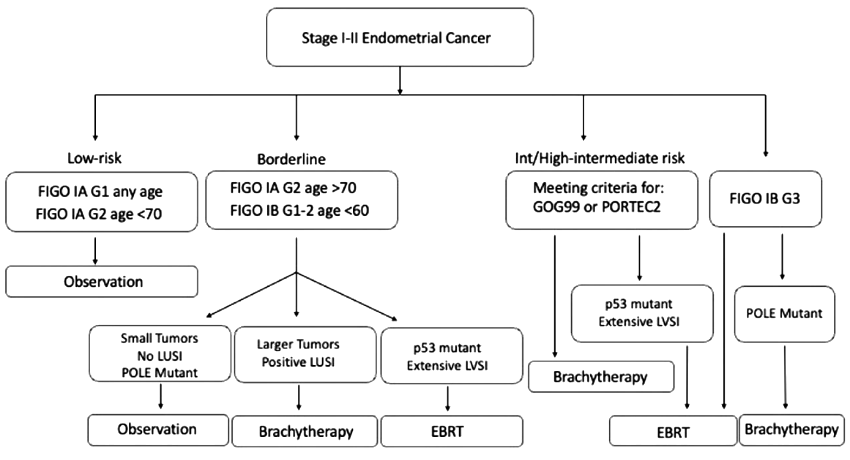
Рисунок 2. Рекомендации по тактике лечения больных ранним раком эндометрия [30].
Во-первых, как было упомянуто выше, минимум половину случаев составляют опухоли без определенного молекулярного портрета (NSMP опухоли), при которых молекулярная диагностика имеет мало смысла, а случаи очевидно благоприятного и очевидно неблагоприятного прогноза относительно редки.
Во-вторых, дискутируя о показаниях к адъювантной лучевой терапии, мы часто забываем о первом этапе лечения – операции и ее объеме. Во многом рисунок 2 отражает попытку авторов компенсировать дефект стадирования объемом лучевой терапии, что сплошь и рядом случается и в нашей практической жизни, когда пациентке выполняют простую экстирпацию матки (которая до сих пор остается в стандартах лечения) и, обнаруживая глубокое прорастание опухоли и лимфоваскулярную инвазию, отправляют ее на облучение всего таза. По сути, это значит, что имея формально I-II стадию, мы подозреваем скрытую III. Может ли облучение таза компенсировать недостаток лимфодиссекции? В плане локального контроля – возможно, но если это истинная третья стадия, на выживаемость начинает влиять системное лечение, и облучение малого таза не компенсирует отсутствие химиотерапии. Да, обнаружение мутации р53 при распространенной лимфоваскулярной инвазии повышает шансы больной иметь скрытые метастазы в лимфоузлы, и в такой ситуации замена брахитерапии облучением малого таза будет оправдана, но системное лечение по-прежнему выпадает, потому что формально (с точки зрения доказанной IB стадии) к нему нет оснований.
На мой взгляд, внедрение возраста и молекулярного портрета опухоли в алгоритм определения лечебной тактики вполне оправдано, но не может заменить адекватного стадирования. Многие вопросы, порождаемые неблагоприятными морфологическими факторами (ЛВИ, инвазия более 50%), могут отпасть сами собой при наличии информации о состоянии лимфоузлов, тем более что внедрение биопсии сторожевых лимфоузлов, а особенно в сочетании с ультрастадированием (выявлением микрометастазов в удаленном материале путем изготовления супертонких гистологических срезов), вполне способно заменить по степени информативности полноценную лимфодиссекцию, что было доказано клиническими исследованиями.
В идеальном варианте у нас есть возможность биопсии тазовых лимфоузлов с ультрастадированием при любом инвазивном раке эндометрия. Поскольку в ближайшем будущем это едва ли достижимо, в условиях ограниченного доступа к полному хирургическому стадированию возможность определять молекулярный портрет опухоли на этапе предоперационной подготовки (по данным соскоба) будет крайне полезна для отбора больных, которым это 100% необходимо.
Внедрение молекулярной диагностики, вероятнее всего, расширит показания к брахитерапии, которая в слишком многих случаях пренебрегается, даже в Москве, а к этому надо быть готовым – в материально-техническом плане.
Нельзя не признать, что определение молекулярного портрета опухоли эндометрия делает нас ближе к пониманию биологического течения процесса и определению оптимального алгоритма его лечения, и, возможно, мы увидим время, когда, подобно тактике при раке молочной железы, всем больным при инвазивном процессе будет выполняться иммуногистохимическое исследование опухоли и биопсия сигнальных лимфоузлов и лишь затем – определяться окончательный объем лечения.
Источники: