15.01.2024
Гепатоцеллюлярная карцинома (ГЦК) – наиболее распространенный тип рака печени и одна из ведущих причин смертности от рака во всем мире. Неоперабельная опухоль подразумевает наихудший прогноз и крайне плохо поддается консервативному лечению. Медиана выживаемости колеблется от 1,0 до 1,5 лет для симптомных пациентов с распространенной ГЦК, получающих системную терапию. Рекомендуемые системные схемы лечения ГЦК первой линии включают применение однокомпонентных ингибиторов тирозинкиназы (ИТК) – сорафениба и ленватиниба. Кроме того, комбинация атезолизумаба (ингибитора PD-L1) и бевацизумаба стала стандартом системной терапии первой линии по данным исследования IMbrave150 [1,2]. Ряд ингибиторов контрольных точек также продемонстрировали эффективность (ниволумаб, дурвалумаб в комбинации с тремелимумабом, синтилимаб в комбинации с биосимиляром бевацизумаба, одобренные в Китае для азиатской популяции пациентов). Определенный выбор присутствует – но остается проблема токсичности. Хотя сочетание атезолизумаба и бевацизумаба связано с низким риском кровотечения из варикозно расширенных вен у правильно отобранных пациентов, существует более высокий риск кровотечения у пациентов с распространенной ГЦК, у которых больше вероятность портальной гипертензии. Ингибиторы тирозинкиназы рекомендуются пациентам с противопоказаниями к атезолизумабу или бевацизумабу, однако они также связаны с нежелательными явлениями (НЯ), такими как диарея и слабость. Хотя эти НЯ обычно имеют низкую степень тяжести, они могут влиять на качество жизни пациентов и привести к отмене препарата. Экспертные рекомендации рекомендуют монотерапию анти-PD-1 препаратами пациентам с противопоказаниями к терапии ИТК или препаратами анти-VEGF неконтролируемой гипертензией, недавними сердечно-сосудистыми заболеваниями или статусом класса B по Чайлд-Пью. Однако применение однокомпонентного ингибитора PD-1 или PD-L1 еще не одобрено в качестве варианта системного лечения первой линии.
Тислелизумаб представляет собой моноклональное антитело с высоким сродством и специфичностью связывания к PD-1, продемонстрировавшее эффективность и приемлемый профиль безопасности у пациентов с различными солидными опухолями. Тислелизумаб показал стойкую клиническую активность у пациентов с ранее леченной ГЦК в исследовании фазы 2 RATIONALE-208 [3], что требует подтверждения эффективности монотерапии тислелизумабом в первой линии. Недавняя публикация в журнале JAMA Oncology демонстрирует результаты окончательного анализа фазы 3 исследования RATIONALE-301, оценивающего эффективность и безопасность тислелизумаба по сравнению с сорафенибом в качестве лечения первой линии у пациентов с неоперабельной ГЦК [4].
Это открытое многоцентровое рандомизированное клиническое исследование 3 фазы с активным контролем в параллельных группах проводилось с 27 декабря 2017 г. по 2 октября 2019 г. в 117 центрах в Китае, Чехии, Франции, Германии, Италии, Японии, Польше, Испании, Тайване, Великобритании и США.
Пациенты были рандомизированы 1:1 на тислелизумаб 200 мг внутривенно каждые 3 недели или сорафениб тозилат 400 мг перорально два раза в день, до симптоматического ухудшения, связанного с прогрессированием заболевания, неприемлемых токсических эффектов или завершения исследования. Первичной конечной точкой была общая выживаемость (ОВ). Вторичные конечные точки эффективности включали частоту объективных ответов (ЧОО), выживаемость без прогрессирования (ВБП), продолжительность ответа, уровень контроля заболевания (доля пациентов с полным или частичным ответом или стабильным заболеванием) и частоту клинических преимуществ (доля пациентов с лучшим общим ответом, полным или частичным ответом или стабильным заболеванием в течение ≥24 недель). Всего 674 пациента были рандомизированы для лечения и включены в анализ результатов лечения по протоколу (342 в группе тислелизумаба и 332 в группе сорафениба). Всего было 570 (84,6%) мужчин и 104 (15,4%) женщины; средний возраст составил 61 год (диапазон 23-86 лет). Пациенты в целом были хорошо сбалансированы между группами лечения; тем не менее, наблюдались некоторые количественные различия в исходных характеристиках: более значительная доля пациентов в группе тислелизумаба имела позднюю стадию заболевания и отягощающие факторы риска. Минимальный период наблюдения составил 33 месяца.
В исследовании была достигнута основная конечная точка: ОВ при приеме тислелизумаба была не хуже, чем на сорафенибе. Общая выживаемость с тислелизумабом была аналогична таковой для сорафениба через 12 месяцев и численно выше, чем у сорафениба, как через 24 месяца (39,0% против 31,8%), так и через 36 месяцев (29,2% против 20,3%) (рис.1).
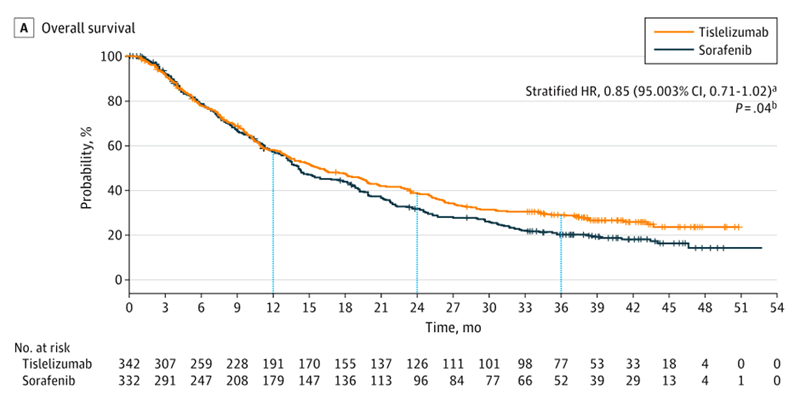
Рисунок 1. ОВ в группах тислелизумаба и сорафениба.
Частота объективных ответов составила 14,3% (n=49) для тислелизумаба против 5,4% (n=18) для сорафениба, а медиана продолжительности ответа составила 36,1 мес. (95% ДИ от 16,8 до не поддающихся оценке) против 11,0 мес. (95% ДИ 6,2-14,7) соответственно. Медиана выживаемости без прогрессирования составила 2,1 мес. (95% ДИ 2,1-3,5) против 3,4 мес. (95% ДИ 2,2-4,1) в группе тислелизумаба по сравнению с сорафенибом (ОР 1,11; 95% ДИ 0,92-1,33). Хотя в группе сорафениба медиана ВБП была более продолжительной и отмечен более высокий показатель ВБП через 6 месяцев, чем в группе тислелизумаба (35,8% против 28,8%), показатели ВБП были одинаковыми в обеих группах через 12 месяцев (19,0% против 18,1%) и выше в группе тислелизумаба через 18 и 24 месяца (18 месяцев: 16,1% против 9,5%; 24 месяца: 13,9% против 6,1%) (рис.2).
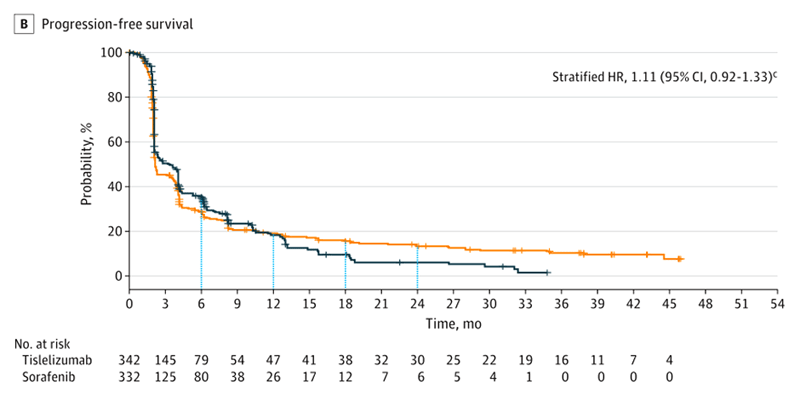
Рисунок 2. ВБП в группах тислелизумаба и сорафениба.
Частота нежелательных явлений (НЯ), возникших во время лечения, составила 96,2% (325 из 338 пациентов) для тислелизумаба и 100% (n=324) для сорафениба. Связанные с лечением НЯ 3-й степени и выше были зарегистрированы у 75 пациентов (22,2%), получавших тислелизумаб, и у 173 (53,4%) получавших сорафениб.
Таким образом, в исследовании RATIONALE-301 монотерапия тислелизумабом продемонстрировала сопоставимую ОВ, а также более высокие и более длительные объективные ответы по сравнению с сорафенибом, в то время как частота контроля над опухолью и медиана ВБП были в пользу сорафениба. Тислелизумаб имел благоприятный профиль безопасности по сравнению с сорафенибом. Эти результаты показывают, что тислелизумаб представляет собой потенциальный вариант лечения первой линии для пациентов с неоперабельной ГЦК.
Источники: