11.01.2024
Интересное исследование, заставляет нас задуматься, можем ли мы использовать частоту достижения pCR как первичную конечную точку в работах, изучающих периоперационную терапию при раке желудка (РЖ) и кардиоэзофагеального перехода (КЭП).
Напомним, что в настоящий момент проведение периоперационной химиотерапии при РЖ и КЭП рекомендовано пациентам начиная со стадии T2N0M0, а оптимальным и предпочтительным режимом на основании исследования FLOT4, опубликованного в далеком 2019 году, является режим FLOT. Применение схемы FLOT в сравнении с ECX позволило увеличить частоту pCR в 2,5 раза, медиану ВБП – с 18 до 30 мес. (p=0,0036) и медиану ОВ – с 35 до 50 мес. (p=0,012) соответственно.
Однако результаты терапии локализованного РЖ и КЭП остаются неудовлетворительными. Опубликованные обнадеживающие результаты исследований KEYNOTE-859, CHECKMATE-649, SPOTLIGHT, GLOW, посвященных изучению таргетной терапии/иммунотерапии при диссеминированном РЖ, позволяют активно ее изучать и при первично операбельном РЖ и КЭП.
В декабре 2023 г. в The Lancet Oncology представлены предварительные результаты исследования 3 фазы KEYNOTE-585, посвященные целесообразности добавления пембролизумаба к периоперационной химиотерапии в режиме PF/FLOT при раке желудка и кардиоэзофагеального перехода II-IVa.
С 9 октября 2017 г. по 25 января 2021 г. 804 пациента T3N0-1 или T0-4N+ рандомизированы в когорту PF ± пембролизумаб и 203 больных – в когорту FLOT ± пембролизумаб. Первичными конечными точками работы были частота достижения полного патоморфоза (pCR), токсичность и медианы бессобытийной (EFS) и общей (ОВ) выживаемости.
В настоящий момент опубликованы результаты терапии 1 когорты, в которой 804 пациента рандомизированы (1: 1) в две лечебные группы:
Необходимо отметить, что исследование характеризовалось сложным дизайном, и уровень статистической значимости, при котором добавление пембролизумаба к химиотерапии в режиме PF/PX позволяло бы говорить об увеличении мEFS, был оценен как α=0,0005.
Большинство пациентов, включенных в когорту PF/PX ± пембролизумаб, были мужчинами (72%) с ECOG 0 (75%) и медианой возраста 64 года. Опухоль чаще локализовалась в желудке (79%) и в 73% случаев CPS оценен как ≥1. У 9% больных зарегистрирован MSI-H.
При медиане времени наблюдения в 47,7 мес. добавление пембролизумаба к режиму PF/PX позволило увеличить частоту достижения pCR c 2,0% до 12,9% (p<0,0001). Максимальный эффект от комбинации пембролизумаба с PF зарегистрирован при CPS ≥1 и MSI-H.
Несмотря на то, что численно медиана EFS была выше в группе с пембролизумабом (25,3 мес. против 44,4 мес. соответственно), статистической достоверности различия не достигли – p=0,0198 (рис.1).
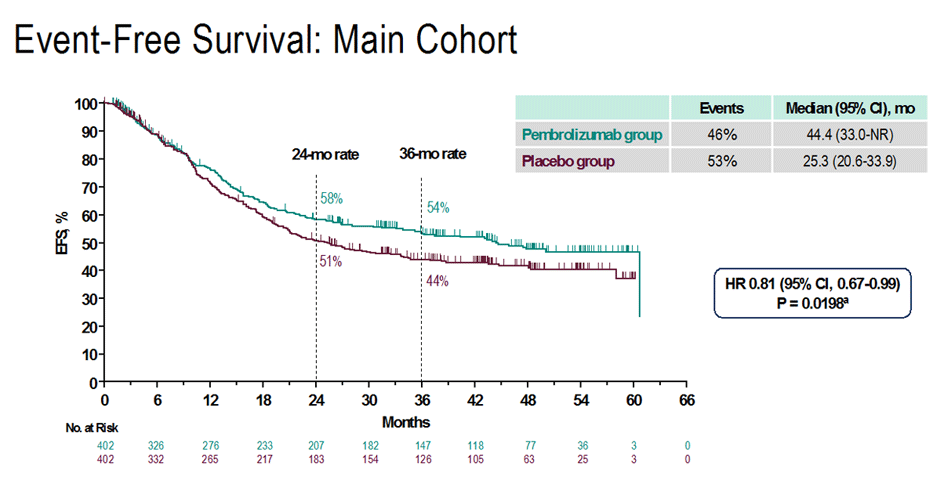
Рисунок 1. График бессобытийной выживаемости.
Добавление иммунотерапии также не позволило значимо увеличить 24- и 36-месячную ОВ в группах, которые достигли 72% и 65% против 69% и 60% соответственно.
НЯ 3 степени и выше зарегистрированы у 312 (78%) больных в группе с пембролизумабом и у 297 (74%) пациентов в группе плацебо и были преимущественно представлены тошнотой (60% vs 62%), анемией (42% vs 40%) и снижением аппетита (41% vs 43%). Серьезные НЯ, связанные с лечением, были зарегистрированы у 102 (26%) и 97 (24%) пациентов в лечебных группах соответственно. В целом профиль токсичности был управляем и ожидаем.
Источники: