05.04.2022

«To PORT or not to PORT» – это, пожалуй, одна из наиболее дискутабельных тем в радиационной онкологии последних лет. При этом крупные рандомизированные исследования, такие как Lung-ART (2021) и PORT (1998), вроде бы, ставят однозначную точку в данном вопросе: послеоперационная лучевая терапия не показана рутинно больным немелкоклеточным раком легких с N2 при условии полной резекции.
Однако при внимательном рассмотрении результатов складывается впечатление, что все не так уж однозначно.
Итак, целесообразность проведения послеоперационной лучевой терапии (PORT) у радикально прооперированных больных немелкоклеточным раком легкого вот уже на протяжении более 2 десятков лет волнует умы исследователей и практикующих врачей – с тех пор, как в конце 90-х годов 20 века появились результаты первого крупного метаанализа, продемонстрировавшего крайне негативное влияние облучения на общую выживаемость прооперированных больных [1]. Однако важным было то, что все же нашлась группа больных, у которых PORT не ухудшала, а, пожалуй, даже немного улучшала результаты лечения – это пациенты с НМРЛ III стадии и N2.
Еще одним существенным недостатком данного метаанализа (с современной точки зрения) было то, что из почти 2000 включенных больных большая часть получала даже не конформную, а просто 2D-лучевую терапию, при котором огромный объем здоровой ткани, как легочной, так и средостения, в том числе сердце, получали значительную лучевую нагрузку. До начала активного и повсеместного внедрения технологий 3D-конформной ЛТ и модуляции интенсивности пучка излучения еще должно было пройти несколько лет. А основные неудачи применения PORT как раз и были, как сразу отметили авторы, связаны именно с неожиданно высокой токсичностью облучения, в том числе результирующего снижения показателей выживаемости. И также не стоит забывать о том, что в те времена было принято облучать все группы лимфоузлов средостения, а не выборочно, как это делается сейчас. Очевидно, такой подход только увеличивал токсичность лечения. Еще одним серьезным недостатком анализа является неоднородность доз и режимов фракционирования. В метаанализ были включены как классические режимы по 2 Гр до 60 Гр, так и скорее паллиативные, к примеру, 30 Гр за 10 фракций.
Но самым шокирующим итогом стал сам факт того, что PORT заметно ухудшала результаты лечения больных с НМРЛ – как минимум на 7% в течение 2 лет наблюдения (95% CI 3-10), снижая ОВ с 55% до 48%. Эти цифры во многом сформировали мнение о целесообразности PORT на десятилетия вперед, оставив для дискуссии лишь одну группу – с N2 и III стадией.
Шли годы, развивались технологии, добавлялись новые исследования в «копилку» работ по адъювантному облучению при раке легкого, но ситуация оказывалась прежней: добавление лучевой терапии, по уже сформированному мнению исследователей, не только не улучшало, но даже ухудшало общую выживаемость прооперированных пациентов.
На протяжении нескольких лет, тем не менее, международные клинические рекомендации включали лучевой метод на адъювантном этапе, но только для определенной̆ категории пациентов – с R+ резекцией и поражением лимфоузлов средостения (N2), именно благодаря одному выводу метаанализа 1998 года. Более того, ряд исследований продемонстрировал преимущества облучения у таких больных, в частности, данные крупного анализа на основе Национальной базы данных США от Robinson et al. [2], однако четких доказательств этого не было, поскольку данные были преимущественно ретроспективными. Тем не менее, прибавка в выживаемости была весьма ощутимой: медиана ОВ составила 45 против 40 месяцев (без PORT), а 5-летняя ОВ – 39,3% против 34,8% (без PORT).
В этой связи отчаянно требовались результаты проспективных рандомизированных исследований. Главным нерешенным вопросом по-прежнему оставался только один: дает ли PORT преимущества у пациентов с вовлеченными лимфоузлами средостения (N2)? Результаты долгожданного рандомизированного исследования 3 фазы Lung ART были представлены на конгрессе ESMO в 2020 году, публикация появилась ближе к началу 2022 года [3]. Lung ART, инициированное еще в 2007 году, было призвано оценить роль адъювантного облучения средостения с применением современных технологий лучевой терапии у адекватно стадированных и радикально прооперированных больных НМРЛ с N2. Всего 501 пациент был включен, из них 252 получали PORT в течение 5 недель, а 249 вошли в контрольную группу. В итоге выживаемость без прогрессирования составила 47,1% с PORT и 43,8% в группе наблюдения, без статистической достоверности (p=0,16), общая выживаемость за 3 года оказалась также сопоставима (66,5% с PORT против 68,5% в контроле). При этом PORT почти наполовину снизила риск рецидива в средостении (25% против 46%) – но ценой более высокой сердечно-легочной токсичности, ставшей причиной смерти у 16,2% больных против 2,0% в группе контроля. В целом кардио-пульмональные осложнения 3-4 степени отмечены у 10,8% пациентов после PORT и у 4,9% из наблюдаемых больных.
Это исследование стало основным аргументом специалистов, выступающих против применения PORT у пациентов с N2. Однако если присмотреться внимательно, то вывод, сделанный̆ главным исследователем Cecile Le Pechoux, – это то, что только 3D-конформная PORT не может быть рекомендована как стандарт адъювантного лечения больных с II/III стадией НМРЛ с N2: «Lung ART evaluated 3D conformal PORT after… Conformal PORT cannot be recommended as the standard of care».
В отношении иных методик лучевой терапии (IMRT, VMAT, протоны) этот вопрос по-прежнему остается открытым, так как фактором, определяющим прогноз выживаемости, и здесь оставалась преимущественно лучевая токсичность.
Свою лепту в эту неопределенность в отношении места PORT вносил и тот факт, что проблемой клинических исследований была, есть и будет некая «стерильность» среды, когда в анализ включаются специально отобранные клинические случаи, идет абсолютное соблюдение протокола, а пациенты добросовестно выполняют все рекомендации. Сомнительные случаи безжалостно отсеиваются, и вот мы уже имеем приемлемые для авторов результаты.
В медицине существует немало примеров, когда препарат или метод лечения, демонстрировавший эффективные результаты во время идеальных условий проведения протокола, с треском проваливался в «реальной» жизни. Увы, но и врачи, и пациенты, и даже сотрудники фармацевтической фабрики, расфасовывающие таблетки по блистерам, – все могут допускать преднамеренные, но чаще – непреднамеренные ошибки.
Если же мы берем наш конкретный случай послеоперационного облучения рака легкого, то сразу же сталкиваемся с огромным количеством вовлеченных специалистов, начиная от хирургов и патоморфологов и заканчивая физиками и лучевыми терапевтами.
Проспективное рандомизированное исследование китайских авторов PORT-c [4], на наш взгляд, в очередной раз поставило жирное многоточие на проблеме послеоперационного облучения больных с резектабельным НМРЛ III стадии с поражением лимфоузлов средостения (N2), предоставив скорее больше аргументов «за», чем «против». За период с 2009 по 2017 год были рандомизированы 394 пациента с IIIA pN2 стадией НМРЛ, но в окончательный анализ вошли 364 больных (184 в группе PORT, 180 в группе контроля). Трехлетняя ВБП в группе PORT составила 40,5% против 32,7% в контрольной группе, при этом медиана выживаемости также была выше в группе PORT – 22,6 мес. против 18,6 мес. в контроле (HR 0,84; 95% CI 0,65-1,09; P=0,20). И вновь, несмотря на номинально превосходящие результаты в группе PORT, статистической значимости они не возымели.
Однако когда авторы проанализировали результаты лечения 310 больных, лечение и наблюдение за которыми велось в абсолютном соответствии с протоколом исследования, значимые различия в ВБП в пользу группы PORT все же были найдены (42,8% против 30,6%; HR 0,75; 95% CI 0,57-1,00; P=0,05). Выживаемость без локальных рецидивов ожидаемо и значимо была выше в исследуемой группе (71,9% против 58,4%; HR 0,56; 95% CI 0,39-0,80). Особенно стоит отметить, что авторы провели фактически несколько статистических анализов, включая: 1) всю популяцию (mITT), 2) строгих приверженцев протокола (PP), 3) пролеченных «как есть» (AT).
Ни один из аналитических подходов не продемонстрировал убедительного влияния PORT на общую выживаемость, хотя в группе PP было отмечено увеличение ВБП после проведения облучения (HR 0,75).
Среди факторов, которые затрудняют правильную интерпретацию данных, авторы отмечают именно невысокую степень приверженности лечению. Как было уже отмечено ранее, это частое явление, и мы все понимаем, что «идеальных» пациентов просто не существует и всегда могут быть отклонения от запланированного курса лечения. Мы живем в реальном мире, в котором достаточно большое количество непрогнозируемых интеракций, потенциально влияющих на исходы лечения, и это не всегда касается именно медицинской части. Поэтому очень важен выбор метода терапии, который будет полезен вне зависимости от строгости следования протоколу.
Компилируя полученные данные с результатами LungART, наши китайские коллеги также делают вывод о том, что проведение послеоперационной конформной! лучевой терапии при IIIA pN2 стадии и полной резекции опухоли не улучшает результаты лечения в целом, хотя имеются и некоторые положительные моменты (например, локальный контроль, приемлемая токсичность и т.д.).
Время и технологии не стоят на месте. То же исследование Lung-ART, PORT-С и, в первую очередь, PORT метаанализ были инициированы в конце 80-х – начале 2000-х годов, когда о массовом использовании модулированных методик облучения только начинали мечтать.
Значит ли это, что современная PORT может улучшить результаты лечения больных НМРЛ N2? Вполне возможно.
Так, в 2015 году руководитель службы лучевой терапии MD Anderson профессор Chang делает однозначный вывод о необходимости использования только модулированных методик (рис.1) при облучении рака легкого, в ином же случае токсичность лечения может нивелировать потенциальные выигрыши [5].
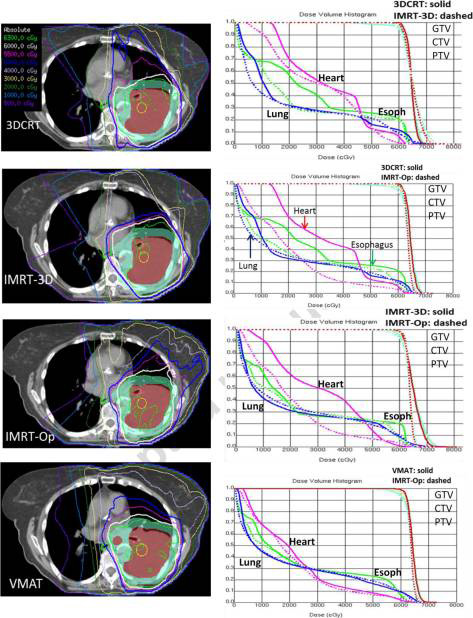
Рисунок 1. Дозиметрические планы различных методик лучевой терапии, применяемых при лечении рака легкого.
Далее, если уже критически разобрать результаты Lung-AR, то бросается в глаза следующее: было обнаружено, что пациенты, получавшие PORT, вроде как не имели существенной разницы в 3-летней безрецидивной выживаемости (DFS) или OS по сравнению с пациентами, которые не облучались, хотя получена 15% (!) прибавка в DFS у пациентов, получавших PORT. Среди пациентов, получивших PORT, было меньше смертей из-за прогрессирования и рецидивов в средостении, но это нивелировалось увеличением сердечно-легочных осложнений 3-4 степени и даже летальных исходов из-за токсичности, связанной с лечением.
Очевидно, что объективную критику Lung-ART не в состоянии выдержать, потому как 89% пациентов облучали с использованием устаревшей к сегодняшнему дню 3D-конформной лучевой терапии, что напрямую ассоциировано с увеличением сердечной и легочной токсичности по сравнению с модулированными по интенсивности методиками (IMRT). Выходит, что больные заведомо получали лечение по методике, имеющей более высокие риски осложнений.
Тем не менее, всего лишь на основе тезисов об отрицательных результатах этого исследования роль PORT для НМРЛ III-N2 R0 стадии была категорически отвергнута на конгрессе ESMO.
В исследовании PORT-C, напротив, 89% больных получали IMRT. И хотя абсолютного доказательства пользы PORT авторы не увидели, тем не менее, как было описано ранее, при определенных условиях PORT имеет смысл.
Вероятнее всего, определяющим фактором является количество и локализация пораженных лимфоузлов. Так, в PORT-C улучшение DFS было отмечено у больных с 4+ пораженными лимфоузлами. В еще более раннем исследовании Matsuguma et al [6] было показано, что облучение улучшает результаты при многоуровневом поражении лимфоколлекторов, а также для больных, у которых отмечаются резидуальные лимфоузлы после индукционной химиотерапии [7-9].
Однако и по сей день не было рандомизированных исследований на этот счет.
Наличие/отсутствие экстракапсулярной инвазии также может быть фактором, при котором стоит проводить PORT. Так, Moretti et al еще в 2009 году показали, что послеоперационное облучение у больных без экстракапсулярной инвазии в лимфоузлах заметно повышает OS и не влияет на результаты при наличии таковой [10].
Стоит отметить, что патоморфологическая классификация уже давно играет не самую главную роль в выборе тактики лекарственного лечения. Вероятно, молекулярно-генетический анализ может быть полезен и для лучевого лечения. К примеру, Wu et al [11] пришли к выводу, что у пациентов с EGFR+ НМРЛ, которым будут проводить терапию осимертинибом, смысл в PORT автоматически отпадает. А тем, у кого ничего из классической триады (EGFR, ALK, ROS) не определяется и, соответственно, не так много эффективных опций системной терапии, локальные методы (облучение) могут принести заметную пользу.
Подводя итоги, хочется отметить, что решение вопроса о целесообразности PORT при НМРЛ N2 R0 лежит, на наш взгляд, совершенно не в плоскости примитивного выбора «да или нет». Аргументы «за» и «против» всегда могут быть подвергнуты сомнению, что и продемонстрировал данный обзор. При этом становится почти очевидно, что существуют патоморфологические и молекулярно-генетические предпосылки, при наличии которых облучение можно и нужно проводить, и делать исключительно современными методиками: IMRT, VMAT, протоны (табл.1) [12], однако этот вопрос требует тщательного изучения и инициации рандомизированных исследований.
| Клиническая ситуация | PORT? | Почему? |
|---|---|---|
| Резидуальные N2 после индукции | Да | SAKK trial: результаты у больных с yрN0-1 лучше |
| Обширное вовлечение N2 | Вероятнее всего | PORT-C trial: PORT при N2 от 4+ лимфоузлов улучшает DFS |
| Экстракапсулярная инвазия | Возможно, хотя спорно | Vanderbilt et al: PORT улучшает OS, если нет инвазии |
| EGFR-, ALK-, ROS- | Пока непонятно | ADAURA trial: при проведении таргетной терапии DFS улучшается. А если нет – спорно |

Главный принцип врачевания – Noli nocere (не навреди – лат.) Чтобы следовать этому принципу, нужно быть абсолютно уверенным, что ты, если не сделаешь лучше, то хотя бы не навредишь. И вот почти четверть века в среде радиотерапевтов (и не только) остается актуальным вопрос – выполнять или воздержаться от лучевой терапии у пациентов с немелкоклеточным раком легкого (НМРЛ) со статусом поражения лимфатических узлов N2 после хирургического лечения? Чтобы ответить на этот вопрос, нужно решить уравнение с несколькими неизвестными, где по одну сторону знака «равно» будет стоять «лучевая терапия», а по другую – «безопасность + эффективность». К неизвестным же мы отнесем риски и вероятности, числа которым не счесть. Соответственно, и абсолютной уверенности в безопасности такого лечения быть не может, пока мы с этими неизвестными не разберемся. Благодаря многочисленным исследованиям, многие неизвестные раскрыты, но очевидность, что между «лучевая терапия» и «безопасность + эффективность» должен стоять знак «равно», а не «не равно», пока отсутствует. Попробуем разобраться с этими неизвестными, а затем определимся и с аргументами, почему при стандартном подходе мы будем ПРОТИВ лучевой терапии в адьювантном режиме при N2 статусе лимфоузлов у пациентов с НМРЛ, и почему между «лучевая терапия» и «безопасность + эффективность» в рутинном алгоритме выбора лечебной тактики должен стоять знак «не равно».
Для начала вспомним, что такое N2 стадия? Это, согласно классификации TNM и клинического стадирования при раке легкого, поражение ипсилатеральных медиастинальных и/или субкаринальных лимфатических узлов [1]. Именно эти группы лимфоузлов находятся на критически близком расстоянии от такого критического органа, как сердце. Надо заметить, жизненно важного органа. Соответственно, когда мы решаемся воздействовать высокими дозами радиации на область лимфоколлектора N2, мы гарантированно будем воздействовать на миокард и коронарные артерии, на клапаны сердца и на самые крупные сосуды – аорту, легочные артерии и легочные вены, по которым в единицу времени протекает наибольшее количество крови. Воздействуя излучением на область N2, мы также облучаем большой пул форменных элементов крови, протекающей по этим крупным сосудам. Эндотелиальные клетки обладают высокой радиочувствительностью, и дозы выше 2 Гр могут запускать воспалительные каскады, способствующие развитию атеросклероза. В сочетании с протромботическим состоянием при злокачественной опухоли это может привести к таким осложнениям, как стенокардия, острый коронарный синдром, инфаркт миокарда, злокачественные аритмии и смерть [2], что продемонстрировано во многих исследованиях. Ретроспективный анализ 748 пациентов с местнораспространенным НМРЛ, получавших лучевую терапию, убедительно свидетельствует о том, что, несмотря на конкурирующий риск смерти от рака и короткую продолжительность жизни у пациентов с местнораспространенным НМРЛ, существует высокий риск серьезных неблагоприятных сердечных событий (major adverse cardiac events, МАСЕ) в течение 2 лет после лучевой терапии, а доза излучения на сердце является независимым предиктором MACE степени ≥3 CTCAE [3]. Очевидно, что лучевая терапия ускоряет развитие ишемической болезни сердца (ИБС), но доза облучения критических структур сердца при раке легкого систематически не изучалась. Когортное исследование 701 пациента с местнораспространенным НМРЛ, получавших торакальную лучевую терапию в больницах Гарвардского университета в период с 1 декабря 2003 г. по 27 января 2014 г., показало, что оптимальные пограничные дозы для сердца могут различаться в зависимости от наличия предшествующей ИБС. Показатель V15 (то есть объем органа, получающий дозу 15 Гр) для левой передней нисходящей коронарной артерии ≥10% является независимой оценкой вероятности MACE и смертности от всех причин, особенно у пациентов без ИБС, а V15 для левого желудочка ≥1% придает повышенный риск MACE среди пациентов с ИБС [4].
Если до недавних пор мы могли опираться только на рандомизированные и ретроспективные исследования и их метаанализы прошлого века, то теперь мы можем рассмотреть результаты двух современных крупных рандомизированных контролируемых исследований III фазы, оценивающих целесообразность адъювантной лучевой терапии при полностью резецированном НМКРЛ со статусом N2. Итак, Lung ART (мультицентровое, набор 2007-2018 гг., в исследование был включен 501 пациент) и PORT-C (одноцентровое, набор 2008-2019 гг., приняли участие 364 пациента).
Оба исследования показали, что PORT уменьшает местно-регионарные рецидивы, но не увеличивает выживаемость, и возражения против PORT, таким образом, вызывают некоторую путаницу при принятии клинических решений [5]. В исследовании Lung ART фактическая частота медиастинального рецидива в контрольной группе составила 46%, а PORT значительно снизила частоту до 25%, в то время как 3-летняя общая выживаемость в контрольной группе составила 69% (95% ДИ 61-75%) и 67% (95% ДИ 59-73%), оказавшись ниже в группе PORT. Трехлетняя безрецидивная выживаемость составила 47% (95% ДИ 40-54) с PORT по сравнению с 44% (37-51) без PORT, а медиана безрецидивной выживаемости составила 30,5 мес. (95% ДИ 24-49) в группе PORT и 22,8 мес. (17-37) в контрольной группе (отношение рисков 0,86; 95% ДИ 0,68-1,08; р=0,18) Наиболее частыми нежелательными явлениями 3-4 степени были пневмонит (13 [5%] из 241 пациента в группе PORT против одного [<1%] из 246 в контрольной группе), лимфопения (9 [4%] против 0) и усталость (шесть [3%] против одного [<1%]) [6]. Надо отметить, что 89% пациентов в группе PORT из Lung ART получили 3D-конформную лучевую терапию, а в исследовании PORT-C 89% пациентов лечили IMRT. Фактические средние значения при PORT-C V20 для легких и V30 для сердца составляли 16,7% и 10,4% соответственно (V20 для легких и V30 для сердца составляли 23% и 15% при Lung ART) [5].
Ключевым выводом исследования Lung ART является значительное увеличение ранней и поздней степени сердечно-легочной токсичности 3-5 степени при проведении PORT (7% и 20% для PORT по сравнению 3,2% и 7,7% без PORT соответственно), что объясняет отсутствие достоверной разницы в общей выживаемости.
В исследовании PORT-C показатели 3-летней общей выживаемости составили 78,3% против 82,8% (HR 1,02; P=0,93), а LRFS – 66,5% против 59,7% (HR 0,71; 95% ДИ 0,51-0,97; P=0,03) соответственно. Для 310 пациентов, пролеченных в соответствии с протоколом (140 с PORT и 170 с наблюдением), PORT значительно улучшила DFS (42,8% против 30,6%; HR 0,75; 95% ДИ 0,57-1,00; P=0,05), но не общую выживаемость (HR 0,83; 95% ДИ 0,53-1,30; P=0,41). Частота только местных рецидивов в течение 3 лет составила 9,5% и 18,3% в 2 группах соответственно [7].
Кроме того, объемы и дозы облучения в обоих следованиях тоже отличались. Если в Lung ART суммарная доза облучения (СОД) составляла 54 Гр при большем объеме облучения и 3D-конформной технике, то в PORT-C подводилась СОД 50 Гр при технике IMRT и меньшем объеме облучения, что в целом не сильно отразилось на общей выживаемости пациентов в обоих исследованиях.
Еще важно заметить, что ни в том, ни в другом исследовании не сопоставлялась эффективность лечения в зависимости от морфологической принадлежности опухоли и не учитывалось использование таргетной терапии осимертинибом в адъювантном режиме или при прогрессии. Но есть исследование, в котором сравнили ответ на ПОРТ при аденокарциноме легкого (АКЛ) и при плоскоклеточном раке легкого (ПКРЛ). И разница оказалась очень заметной. В период с октября 2010 г. по сентябрь 2016 г. был проведен ретроспективный анализ 288 пациентов с полностью резецированным НМРЛ pIIIA-N2 в Пекинской больнице, который состоял из 194 случаев АКЛ и 85 случаев ПКРЛ. Было 42 (21,6%) пациента, получавших PORT в случаях АКЛ, и 19 (22,3%) пациентов, получавших PORT при ПКРЛ.
Среди 194 больных с АКЛ 1-, 3- и 5-летняя ОВ в группе PORT составляли 95,2%, 61,9% и 40,0% соответственно, а в группе без PORT – 90,1%, 63,3% и 45,0% (р=0,948). Использование адъювантной химиотерапии (АХТ) и индекс курения ≥400 были прогностическими факторами 5-летней частоты ОВ, выживаемости без локального рецидива и выживаемости без отдаленных метастазов. С другой стороны, среди 85 случаев ПКРЛ 1-, 3- и 5-летняя ОВ в группе PORT составили 94,7%, 63,2% и 63,2% соответственно, тогда как в группе без PORT – 86,4%, 48,5% и 37,1% (р=0,026). В этой группе использование PORT было благоприятным прогностическим фактором для 5-летней ОВ, LRFS и DMFS [8].
Чтобы назначить или не назначить правильное лечение, необходимо быть уверенным в объеме выполненного хирургического лечения, когда радикальность предполагает: 1) свободные (чистые) края резекции мягких тканей вокруг опухоли, бронхиальной, венозной, артериальной культей (R0), 2) должно быть удалено как минимум 6 лимфоузлов, из которых 3 – внутрилегочные и 3 – медиастинальные (из которых минимум 1 – субкаринальный), 3) не должно быть экстракапсулярного распространения в л/у, 4) высший из удаленных средостенных л/у должен быть негативным [9].
Таким образом, мы приблизились к аргументам ПРОТИВ назначения PORT как стандартного лечения при НМРЛ стадии pIII N2, выявив отдельные неизвестные в уравнении, где «лучевая терапия» далеко не всегда равна «безопасность + эффективность»:
Соответственно, PORT не может быть общепринятой практикой адъювантного лечения на основании только стадии заболевания и уровня пораженных лимфатических узлов и, скорее, принесет вред, чем пользу.
Всего проголосовало: 47