
– Уважаемый Сергей Алексеевич, в этом году было создано профессиональное общество онкологов-химиотерапевтов. Пожалуйста, обозначьте основные цели Общества.
Действительно, Учредительное собрание Общества состоялось в июле 2010 года в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, а первое заседание успешно прошло в рамках Российского Онкологического Конгресса. На сегодняшний день в общество вступило 300 человек из различных регионов России. Еженедельно через наш сайт www.rosoncoweb.ru регистрируется в среднем 10 человек.
Наши задачи состоят в следующем:
– Каким образом Общество будет влиять на ситуацию с лекарственным обеспечением в России?
Структура общества подразумевает создание комитетов и комиссий по лекарственному обеспечению, члены которых будут взаимодействовать с законодательными и исполнительными органами на различных уровнях, включая Минздравсоцразвития, разрабатывать стандарты диагностики и лечения онкологических больных, отвечающие уровню современных знаний. Сегодня комитет по лекарственному лечению возглавляют профессор В.М. Моисеенко, профессор И.В. Поддубная (проректор и заведующая кафедрой онкологии Российской медицинской академии последипломного образования Минздравсоцразвития РФ на базе ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член-корреспондент РАМН) и д-р Л.В. Болотина (руководитель отделения химиотерапии МНИОИ им. П.А.Герцена), имеющие большой положительный опыт взаимодействия с Минздравсоцразвития, а также занимающиеся в различные годы разработкой клинических рекомендаций и стандартов. В настоящее время мы ведем переговоры с другими ведущими специалистами в различных областях онкологии с целью их участия в работе комитета. Также мы взаимодействуем с некоммерческим партнерством «Здоровое будущее», объединяющим нашу организацию и общество гематологов. В рамках этого сотрудничества планируется единая PR-кампания по привлечению внимания государства к нуждам онкологии. Надеюсь, что члены нашего общества могут и будут влиять на уровне диспансера, города, региона и т.п. на ситуацию с лекарственным обеспечением, путем писем, обращений и т.д.
– Стандарты диагностики и лечения, о которых Вы говорите, будут основаны на международных рекомендациях или будут сугубо российскими?
Мы являемся частью мирового научного сообщества, поэтому придумывать свои стандарты, думаю, будет неправильно. Российские рекомендации должны полностью соответствовать уровню современных знаний, однако должны быть частично адаптированы к нашим реалиям. Стандарты, которые мы имеем сейчас, не могут удовлетворять врача. Настоящие российские стандарты больше похожи на список методов и средств, которые могут быть использованы в лечении онкологического пациента, с указанием объема их использования. В этот список часто включаются препараты, не имеющие отношения к заболеванию. Например, антибиотики. Стандарты и рекомендации, предлагаемые нами, будут являться руководством к действию практического врача в той или иной клинической ситуации, что позволит в итоге сэкономить деньги государства, определяя четкий план действий, без лишних затрат. Также я считаю, что такие рекомендации должны быть разработаны большой группой экспертов без привязки к конкретному учреждению, обществу и т.п. Как, например, это происходит в США с рекомендациями NCCN, которые разрабатываются специалистами из различных институтов по всей Америке. Такие рекомендации четко продуманы и значимы. Мы хотим перенять этот опыт.
– Планируется ли взаимодействие с другими российскими обществами?
Безусловно, мы открыты для сотрудничества и планируем активно взаимодействовать с другими обществами. Как я уже сказал, мы имеем единую программу с обществом гематологов. Планируем сотрудничество с обществом детских онкологов и другими. В рамках взаимодействия мы будем организовывать общие мероприятия общественно-политического и научного характера.
– А с иностранными профессиональными обществами?
Член Правления общества онкологов-химиотерапевтов, профессор В.М. Моисеенко был выбран Национальным Представителем ESMO (European Society for Medical Oncology) в России. Поэтому мы ожидаем сотрудничество с ESMO по образовательным мероприятиям, которые будут проходить в нашей стране. Сейчас мы ведем переговоры с ASCO (American Society of Clinical Oncology) об организации совместного международного симпозиума с участием ведущих американских и российских специалистов в России, в рамках Российского Онкологического Конгресса 2011. На 2012 год запланировано лицензионное взаимодействие с ASCO по ряду мероприятий, одно из которых – The Best of ASCO – все самое лучшее и интересное по итогам конгресса ASCO 2012. Мероприятие такого формата пройдет впервые в РФ. Для членов нашего общества участие в международных мероприятиях на территории России является бесплатным.
– Если говорить о других мероприятиях, что планируется в следующем году?
Образовательная программа будет интенсивной.
Во-первых, мы планируем проведение циклов, касающихся вопросов диагностики и лечения рака легкого и опухолей желудочно-кишечного тракта, в Южном, Северо-Западном, Дальневосточном, Сибирском, Уральском и Приволжском федеральных округах. Почему мы решили уделить внимание этим опухолям? Потому что на сегодняшний день они составляют более 40% в структуре всех злокачественных новообразований. Т.е. практически каждый онколог столкнется с одной из них.
Во-вторых, Общество поддержит организацию Отечественных Школ Онкологов (ОШО) в регионах. Сегодня ОШО успешно проводятся в Санкт-Петербурге. Тематика этих мероприятий будет самой разнообразной.
В-третьих, при поддержке компании Глак-соСмитКляйн и Ростелекома мы начнем цикл Вебинаров – онлайн конференций, напоминающих телемост. В 17 крупных городах России будут организованы студии. Доклады российских и зарубежных ученых будут доступны всем участникам, находящимся в этих студиях в «прямом эфире». Также участники смогут обсудить доклады и задать вопросы. Развитие онлайн образования в XXI веке является принципиально важным. Это значительно облегчит быстрый доступ к самой современной информации.
В настоящее время наши сотрудники ведут переговоры с организаторами нескольких крупных конференций с целью проведения симпозиумов Общества в рамках мероприятия. Мы готовы рассмотреть предложения наших членов о проведении совместных встреч.
Для членов Московского отделения у нас запланирован ежемесячный цикл научнопрактических семинаров под названием «Как лечить…?». Например, как лечить рак молочной железы, или боль, или метастазы в кости, или фебрильную нейропению… И многое другое. Семинары пройдут в офисе общества в неформальной обстановке. Предполагается выступление лектора, и затем разбор клинических случаев, которые могут быть представлены в том числе и участниками. В рамках семинаров мы можем помочь определиться с тактикой ведения пациентов, которым в настоящее время планируется лечение. Количество участников – 15-20 человек.
И, наконец, мы будем проводить общественно-значимые мероприятия и круглые столы с представителями общественных организаций и Департаментов здравоохранения.
– Предусмотрена ли издательская деятельность?
Общество будет издавать журнал «Практическая Онкология». Это хорошо известный журнал, который выходит сейчас в рамках ОШО. На правлении общества журнал был утвержден печатным органом, достигнута договоренность с издательством. Мы считаем целесообразным увеличить тираж журнала и количество номеров. 4 номера будут традиционно содержать материалы ОШО, а 4 номера – научные статьи членов Общества и других онкологов. Публикация в журнале для членов Общества будет приоритетной и быстрой. Кроме того, члены Общества получат журнал бесплатно. Главным редактором журнала станет д-р Н.В. Жуков (заведующий отделением клинической онкологии ФГУ Федерального научноклинического центра детской онкологии, гематологии и иммунологии).
Также мы планируем выпуск научно-популярной газеты, второй номер которой вы сейчас держите в руках. Общество будет издавать стандарты, о которых я говорил ранее, книги, пособия. Мы готовы рассмотреть финансовую поддержку издания и распространения монографий наших членов.
– Теперь мы видим, что работы у общества много. Справитесь?
Будем надеяться. У нас профессиональная команда и надежные партнеры. Я верю, что все получится!
Т.И. Толкачева, А.Н. Смирнов
«2010 год стал знаковым для всей фармацевтической отрасли было введено государственное регулирование цен, принят новый основополагающий закон «Об обращении лекарственных средств» и одобрена федеральная целевая программа развития фармацевтической промышленности», – сказала на открытии форума «Национальная лекарственная политика» Министр Татьяна Голикова.
Глава Минздравсоцразвития России отметила, что в рамках ФЦП в фармотрасль будут впервые вложены такие большие инвестиции. «Это важно для развития производства на территории России современных и качественных лекарственных препаратов», – пояснила Татьяна Голикова.
В ходе выступления Министр представила основные законодательные инициативы в сфере здравоохранения законопроекты – «Об охране здоровья граждан», «О биомедицинских технологиях», «Об обязательном страховании гражданской ответственности медицинских организаций перед пациентами», а также рассказала о принятом законе «Об обязательном медицинском страховании» и региональных программах развития здравоохранения, на которые в течение 2011-2012 годах будет выделено порядка 460 млрд. рублей.
В числе основных новаций законопроектов Татьяна Голикова назвала переход на единые стандарты и порядки оказания медицинской помощи, установлении единых взносов ОМС на неработающее население, введение оплаты медицинских услуг по полному тарифу.
Определенно, стремление Минздрав соцразвития реформировать систе му страхования и гарантировать в ближайшем будущем лекарственное обеспечение пациентам в соответствии со стандартами, предусмотренными в РФ, пусть не до конца совершенными, является важным.
10 декабря 2010, официальный интернет-сайт Минздравсоцразвития России, Общество онкологов-химиотерапевтов
ДОКЛАД МИНИСТРА ТАТЬЯНЫ ГОЛИКОВОЙ
«КОМПЛЕКСНЫЙ ПОДХОД К ОКАЗАНИЮ ОНКОЛОГИЧЕСКОЙ ПОМОЩИ НАСЕЛЕНИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ»
Общество онкологов-химиотерапевтов разделяет позицию Министра Здравоохранения и Социального Развития Татьяны Голиковой по совершенствованию онкологической помощи населению Российской Федерации. Мы публикуем тезисы доклада и презентацию Министра.
Тезисы доклада:
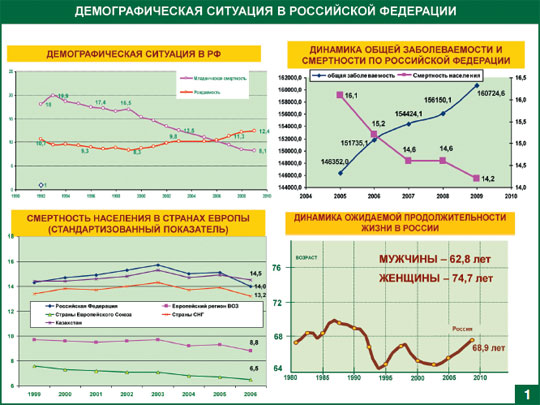
Демографическая ситуация в Российской Федерации характеризуется следующими тенденциями: продолжается устойчивый рост рождаемости на фоне ощутимого снижения младенческой смертности.
При этом динамика показателей общей заболеваемости и смертности с 2006 года является примером раскрывающихся ножниц, говорящих об эффективности реализуемых мероприятий в стране.
Несмотря на снижающийся показатель смертности, продолжительность жизни в России остается недостаточно высокой, за три последних года увеличение произошло на 2,3 года и за 2009 год составила 68,9 лет. При этом продолжительность жизни у мужчин остается крайне низкой несмотря на увеличение на 2,4 года.
Если сравнить общую смертность населения в России и в странах Европы, то мы увидим, что уровень смертности в России остается выше среднеевропейских значений и соответствует общим тенденциям, наблюдаемым в странах Содружества независимых государств.
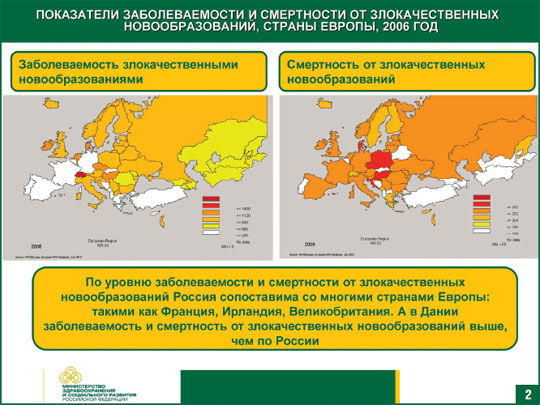
Однако, сравнивая показатели заболеваемости и смертности по злокачественным новообразованиям России и стран Европейского региона, мы не видим значительных отличий с такими странами, как Франция, Ирландия, Великобритания. Например, в Дании, Греции, Венгрии, Нидерландах, Польше, Словении и странах Прибалтики уровень заболеваемости и смертности от злокачественных новообразований намного выше, чем в России.
Оценив место России в Европейском регионе по ситуации со злокачественными новообразованиями, нам еще больше надо приложить совместных усилий в целях совершенствования системного подхода в организации медицинской помощи по профилю онкология, улучшения качества подготовки медицинских кадров, использования отечественного научного потенциала для развития высокотехнологичных методов диагностики и лечения.
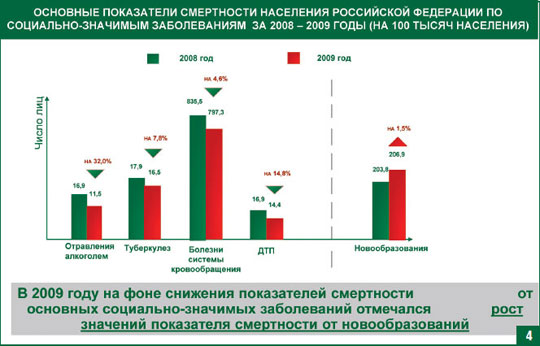
В 2009 году произошел переломный момент, по ряду показателей основных причин смертности наметилась стойкая тенденция к снижению. При этом, по показателям смертности от злокачественных новообразований отмечается рост, это свидетельствует об:
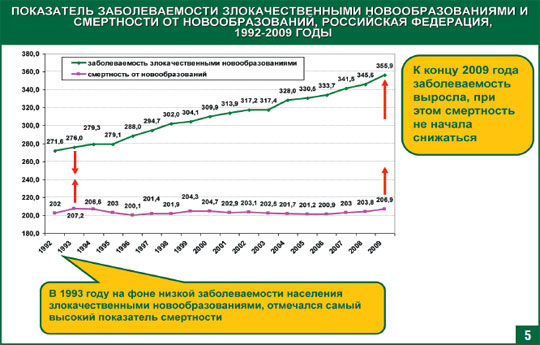
Проведя анализ ситуации по заболеваемости злокачественными новообразованиями за последние 20 лет, можно выделить два периода:
Первый период: 1993 год, когда низкая заболеваемость сопровождалась высокой смертностью. Второй период: это наша действительность, когда наблюдается рост заболеваемости, но при этом снижения смертности не происходит.
На это есть свои причины: так в 1993 году было снижено внимание к профилактической деятельности учреждений первичного звена, резко снизился уровень диспансерных и профилактических осмотров. С 2008 года ситуация в целом поменялась, мы повысили роль профилактической направленности, диспансеризации и профилактических осмотров, что отразилось на росте онкологической заболеваемости.
В силу географических особенностей (большой протяженности, низкой плотности) нашей страны, эндемичности территорий, низким уровнем материально-технического оснащения медицинских учреждений, все регионы условно можно разделить на 3 группы:
Первая группа - регионы с неблагоприятной эпидситуацией:
- с низкой заболеваемостью и низкой смертностью, сложившейся в результате неудовлетворительной работы первичного звена здравоохранения, здесь с большой долей вероятности можно говорить о недорегистрации случаев, как заболеваний, так и смертности.
Это 35 регионов: Республики Ингушетия, Дагестан, Тыва, Калмыкия, Саха, Кабардино-Балкария, Алтай, Бурятия, Марий Эл, Башкортостан, Чувашия, Карачаево-Черкесия, Северная Осетия, Хакасия, Коми, Удмуртия, Чечня, Татарстан, области Тюменская, Амурская, Мурманская, Магаданская, Астраханская, Калининградская, Кировская, края Забайкальский, Камчатский, Пермский, Хабаровский, Ставропольский, все автономные округа и Еврейская автономная область.
- с низкой заболеваемостью и высокой смертностью (9 субъектов), здесь наиболее приоритетными становятся мероприятия по активизации деятельности первичного звена и своевременному выявлению больных со злокачественными новообразованиями. Это Ленинградская, Владимирская, Вологодская, Кемеровская, Московская, Свердловская, Смоленская области, Красноярский, Приморский края.
Всем регионам данной группы стоит обратить внимание на усиление работы по выявлению, лечению, диспансерному наблюдению и правильному кодированию причин смерти.
Вторая группа регионов - это регионы с высокой заболеваемостью злокачественными новообразованиями и высокой смертностью от новообразований, всего 33 региона.
Мы понимаем, что выявление в данных регионах улучшилось, что сразу сказалось на заболеваемости, но внутри выявленных случаев преобладают запущенные формы заболеваний, в 3 и 4 стадии, что не позволяет снизить показатель смертности населения.
Это такие субъекты, как Карелия, Костромская, Воронежская, Томская, Ростовская, Омская, Псковская, Оренбургская, Архангельская, Сахалинская, Тамбовская, Курганская, Челябинская, Нижегородская, Курская, Ивановская, Брянская, Калужская, Ульяновская, Орловская, Тульская, Пензенская, Волгоградская, Тверская, Новосибирская, Рязанская, Ярославская, Новгородская области, города Москва и Санкт-Петербург, Республика Мордовия, Алтайский и Краснодарский края.
Я бы хотела обратить Ваше внимание, что в данных регионах «золотой стандарт» онкологии - пятилетнее дожитие остается низким.
Третья группа - регионы с высокой заболеваемостью и низкой смертностью (5 субъектов), можно отметить удовлетворительную работу первичного звена и онкологических учреждений. К данной группе регионов относятся Белгородская, Иркутская, Саратовская, Липецкая и Самарская области.
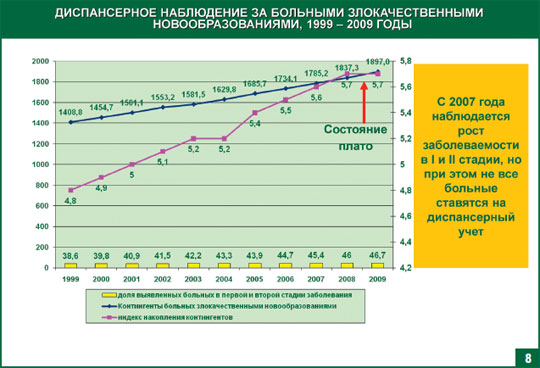
Говоря о выявлении, лечении онкологических заболеваний, особо хочу отметить роль диспансерного наблюдения. В период с 1999 по 2007 годы отмечается следующая тенденция: увеличивалось число больных на ранних стадиях заболеваний и рост охвата больных диспансерным наблюдением.
С 2007 года ситуация стала меняться не в лучшую сторону, когда сформировалось так называемое «плато». Т.е. происходит увеличение числа заболеваний, при этом постановка на учет данной категории пациентов не меняется. Диспансерное наблюдение часть контингента не получает. Обращаю ваше внимание на недопустимость ситуации, именно для этих целей создаются в каждом регионе первичные онкологические кабинеты.
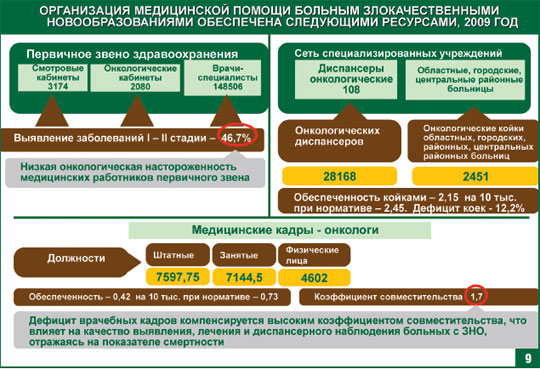
Хотелось бы обратить ваше внимание, что кадрового ресурса в первичном звене достаточно и именно на них лежит бремя выявления онкологических заболеваний на первой и второй стадиях заболеваний, тем не менее, выявление на ранних стадиях остается невысоким, что говорит о недостаточной онконастороженности врачей первичного звена.
Врачи онкологи, несмотря на их недостаточную укомплектованность в регионах, должны справиться с поставленной задачей, так как целая армия врачей терапевтов, стоматологов, дерматовенерологов, хирургов, урологов, гинекологов, оториноларингологов, окулистов, неврологов должны обеспечить значимую помощь врачам-онкологам, не позволяя им распылять свой такой ценный в настоящее время ресурс.
Хотелось бы обратить внимание, что численность врачей-специалистов первичного звена значительна, и, именно на них лежит бремя выявления онкологических заболеваний на первой и второй стадиях заболеваний, тем не менее, выявление на ранних стадиях остается невысоким, что говорит о недостаточной онконастороженности врачей первичного звена.
В 2008 году Правительством России принято решение о необходимости реализации в рамках приоритетного национального проекта «Здоровье» нового направления по совершенствованию медицинской помощи больным с онкологическими заболеваниями, а значит, на снижение заболеваемости, снижение смертности и увеличение продолжительности жизни, поэтому 2009 год стал переломным не только для онкологов России, но и для всего российского здравоохранения. Начиная с 2009 года, в программные мероприятия включаются поэтапно регионы и федеральные учреждения, занимающиеся этой проблемой. Уже выделено на эти цели более 12 млрд. руб., с 2011 по 2013 предусмотрено более 21 млрд. руб.
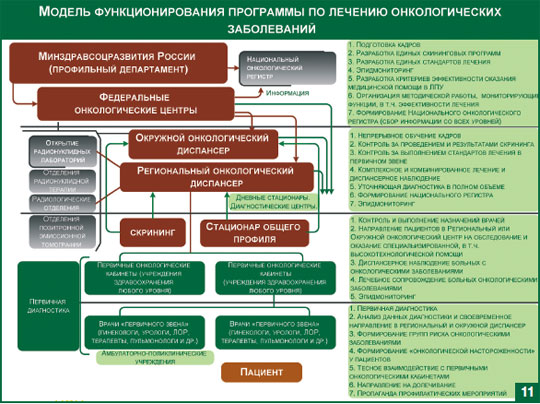
Выстраивая системный подход к организации онкологической помощи населению Министерство совместно с ведущими специалистами в этой области ставит своей целью качественно преобразовать систему оказания первичной и специализированной, в том числе высокотехнологичной медицинской помощи; усилить роль первичного медико-санитарного звена для раннего выявления злокачественных новообразований; и повысить профессионализм медицинских работников. Еще раз хочу обратить ваше внимание на целостный подход и широкомасштабные мероприятия в развитии онкологической службы.
Регионы создают диагностическую, лечебно-реабилитационную базу в существующих онкологических диспансерах. Выстраивают работу первичного звена здравоохранения.
Не меньшая ответственность возложена и на федеральные учреждения, особенно онкологического профиля, основными функциями которых являются:
Министерством завершается процесс гармонизации существующего Национального онкологического регистра и международного противоракового регистра, который позволит не только регистрировать существующую в онкологии ситуацию, но и даст возможность влиять на слабые звенья в системе противораковой борьбы.
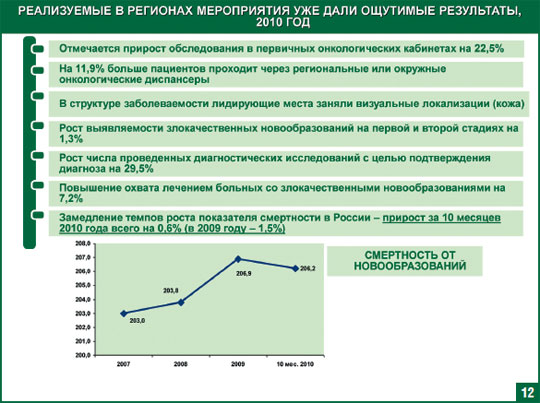
Стартовавшие в 2009 году в регионах мероприятия уже дали ощутимые результаты:
Доступность современной медицинской помощи больным с онкологическими заболеваниями на всех этапах возможно только при четком соблюдении единого лечебно-диагностического процесса.
Именно поэтому, министерством совместно главными специалистами при участии медицинских сообществ разработаны и утверждены порядки оказания медицинской помощи по профилю онкология для детского и взрослого населения, новые стандарты медицинской помощи больным со злокачественными заболеваниями, учитывающие все необходимые современные технологии диагностики и лечения, для использования в работе изданы методические рекомендации.
Прошу Вас в целях улучшения качества оказания медицинской помощи населению Российской Федерации руководствоваться принятыми нормативными правовыми актами и методическими рекомендациями.
Но любые инициативы невозможны без поддержки со стороны науки. Пять лидирующих федеральных научных учреждений онкологического профиля работают по более чем 20 важнейшим направлениям. Все большее развитие получают исследования в части разработки новых методов диагностики и лечения больных. При этом совершенствуются и ныне существующие методы. Изменяются и организационные подходы к оказанию онкологической помощи.
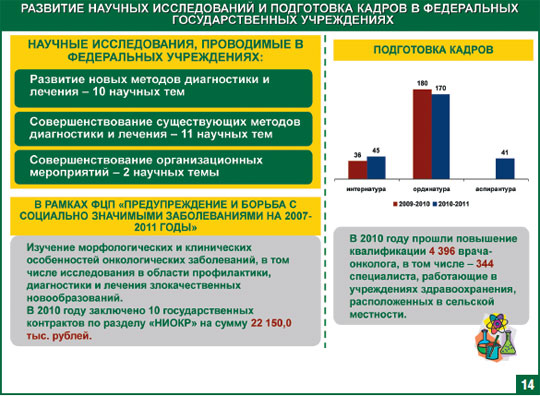
В рамках реализации мероприятий федеральной целевой программы «Предупреждение и борьба с социально значимыми заболеваниями (2007-2011 годы)» подпрограммы «Онкология» в 2010 году заключено 10 государственных контрактов на выполнение научно-исследовательских работ на сумму 22 150,0 тыс. рублей. Результаты этих работ должны быть внедрены в практическое здравоохранение.
Улучшая материально-техническую базу, внедряя стандарты медицинской помощи актуальным становится вопрос: А кто будет работать в отремонтированных учреждениях, на новом оборудовании? Где взять кадровые ресурсы при их дефиците? Одним из решений этой проблемы может стать профессиональная переподготовка врачей. Так, например, только за 2009 и 2010 учебные годы было направлено в интернатуру и ординатуру 472 специалиста, что снизит дефицит врачей - онкологов почти на 10%. Кроме того, в 2010 году прошли повышение квалификации 4 396 врача-онколога, в том числе - 344 специалиста, работающие в учреждениях здравоохранения, расположенных в сельской местности.
В вопросе подготовки медицинских кадров особая роль отводится профессорско-преподавательскому составу образовательных учреждений. Впереди предстоит переход на новые образовательные и профессиональные стандарты. Попрошу всех активизировать работу в этом направлении.
Таким образом, для достижения основной цели в виде снижения смертности от онкологических заболеваний, выявления больных на ранних стадиях и развитие профилактической составляющей в стране имеются все возможности и ресурсы.





13 декабря 2010, Доклад Министра
Минздравсоцразвития Т.Голиковой,
Общество онкологов-химиотерапевтов
7 июня 2010 года, в своем вступительном докладе на клиническом научном симпозиуме ASCO: «Циркулирующие опухолевые клетки при раке молочной железы: текущее состояние проблемы» John W. Park, MD из University of California, San Francisco (UCSF) рассказал краткую историю развития методов выявления циркулирующих опухолевых клеток (ЦОК). В настоящее время современные технологии позволяют выявлять эту крайне малочисленную популяцию клеток. Доктор Park одобрил стремление докладчиков обсудить нерешенные вопросы о клиническом значении выявления ЦОК.
Первый доклад Antonio Giordano, MD, PhD, из University of Texas M. D. Anderson Cancer Center, был посвящен прогностическому значению ЦОК при диссеминированном раке молочной железы. В работе исследовали корреляцию между ЦОК, молекулярным профилем опухоли (определяли иммуногистохимически) и количеством анатомических областей с метастазами (Abstract 1000).
Ретроспективно проанализировано 516 случаев рака молочной железы, последовательно включенных в исследование. У всех больных определяли исходный уровень ЦОК и иммуногистохимический профиль первичной опухоли.
В многофакторной аналитической модели учитывали гормональный рецепторный статус опухоли, экспрессию в опухоли HER2 и анатомические области с метастазами. Относительно общей выживаемости установлена достоверная корреляция с наличием более 5 ЦОК и следующими подтипами опухоли: положительный гормональный рецепторный статус, отсутствие экспрессии HER2 (p = 0,001) и трижды отрицательная форма рака (p = 0,01). Корреляцию на границе статистической достоверности наблюдали для опухолей, положительных по гормональному рецепторному статусу и HER2 (p = 0,064). У больных с HER2-положительным статусом опухоли, получавших лечение трастузумабом или лапатинибом корреляции не было. Также установлена связь между наличием 5 и более ЦОК и метастазами в костях (p = 0,001) (Таблица 1). В заключение, доктор Giordano отметил, что оценка молекулярного профиля будет способствовать более подробной характеристике гетерогенности ЦОК.
Aditya Bardia, MD, MPH, из Johns Hopkins University представил данные Консорциума по проведению трансляционных исследований рака молочной железы (Translational Breast Cancer Research Consortium, TBCRC) по проспективному многоцентровому исследованию биомаркера (TBCRC 005), целью которого стала разработка улучшенных предсказательных и прогностических маркеров в лечении метастатических форм рака молочной железы (Abstract 1001).
Свой доклад доктор Bardia посвятил одной из дополнительных целей исследования: установить влияние ЦОК и циркулирующего опухолевого маркера CA27.29 как вместе, так и отдельно для каждого маркера на прогноз заболевания.
Если исходный уровень CA27.29 превышал 38 Ед/мл, анализ повторяли на 3 или 4 неделе. Количество ЦОК определяли исходно и если оно превышало 5 клеток в 7,5 мл крови, анализ повторяли на 3 или 4 неделе.
Для определения корреляции между маркерами, прогрессированием болезни (между 8 и 12 неделями), выживаемостью без прогрессирования, а также общей выживаемостью использовали ROC-кривые и регрессионную модель Cox.
Из 182 больных участвовавших в исследовании, исходный уровень ЦОК и CA27.29 оценили у 112 женщин. Средний возраст этих больных составил 56 лет, 86% женщин были белыми, 31% больных ранее получили две или менее линии химиотерапии, у 61% опухоль имела положительный эстроген-рецепторный статус, у 21% опухоль была HER2-положительной и у 18 % была диагностирована тройная негативная опухоль. Высокий исходный уровень ЦОК не влиял на выживаемость без прогрессирования, но коррелировал с более короткой общей выживаемостью (p = 0,017).
Установлена связь между высоким уровнем ЦОК на 3 и 4 неделе со снижением выживаемости без прогрессирования (p = 0,006) и общей выживаемости (p = 0,001).
У 60 женщин, которым выполняли повторный анализ ЦОК и CA27.29, изменение уровня CA27.29 являлось независимым фактором прогноза прогрессирования заболевания, а также фактором прогноза выживаемости без прогрессирования и общей выживаемости (p = 0,006, p < 0,0001 и p = 0,0002 соответственно). В использованной модели ROC-анализа только изменение уровня CA27.29 достоверно влияло на прогрессирование заболевания. Подобную картину также наблюдали для 1-летней выживаемости без прогрессирования и для 1-летней общей выживаемости.
Таблица 1. Сокращения: ЦОК – циркулирующие опухолевые клетки;
ЭР – эстрогеновый рецептор; 0В – общая выживаемость.
| Многофакторный анализ Cox | ||
|---|---|---|
| Ковариаты | Отношение рисков (ОВ) (95% доверительный интервал) | P |
| ЦОК ≥ 5 по сравнению с < 5 | 1,978 (1,471 – 2,660) |
<0,001 |
| ЭР-положительные по сравнению с ЭР -отрицательные | 0,485 (0,328 – 0,717) |
<0,001 |
| HER2/neu-положительные по сравнению с HER2/neu-отрицательные | 0,610 (0,420 – 0,885) |
0,009 |
| Висцеральные метастазы по сравнению с другими проявлениями | 1,751 (1,183 – 2,592) |
0,005 |
| Количество анатомических областей с метастазами (1 по сравнению с 2 по сравнению с ≥ 3) |
1,517 (1,207 – 1,907) |
<0,001 |
В заключении доктор Bardia отметил, что в целом оценка количества ЦОК является информативным прогностическим маркером. Однако у женщин с изначально высоким уровнем СА27.29 изменение уровня СА27.29 является независимым и более значимым фактором прогноза заболевания, чем анализ ЦОК. Доктор Bardia считает, что текущие результаты исследования нельзя внедрять в клиническую практику до тех пор, пока они не будут подтверждены данными других исследований.
Иной подход применили исследователи из ОС5Р, они изучали влияние адъювантного применения золендроновой кислоты на опухолевые клетки в костном мозге (ОККМ), которые выявляли у женщин с ранней стадией рака молочной железы высокого риска. Sally Greenberg, MBBS, из UCSF, представила обновленные результаты данного исследования (Abstract 1002).
В пилотном исследовании принимали участие 45 больных, у которых в одном миллилитре аспирата костного мозга были выявлены ОККМ (более 4-х клеток). В дальнейшем больным проводили адъювантную или неоадъювантную терапию. Количество ОККМ оценивали изначально, через 12 месяцев и через 24 месяца. ЦОК измеряли в периферической крови каждые 6 месяцев. Золендроновую кислоту вводили ежемесячно в течение 2 лет.
Отмечена хорошая переносимость золендроновой кислоты. Побочных эффектов 3 или 4 степени не наблюдали. Большинство случаев прекращения участия больных в исследовании было связано с прогрессированием заболевания (5 случаев в первый год и один случай во второй год), а также по личным причинам больных (один случай в первый год и три случая во второй год).
Введение золедроновой кислоты вызывало достоверное снижение количества ОККМ через 12 месяцев по сравнению с исходным уровнем (р = 0,0008), а также при сравнении исходного уровня ОККМ и этого же показателя через 24 месяца (р = 0,0003). У 32% больных через 12 месяцев лечения ОККМ отсутствовали (р < 0,0001), а у 24% ОККМ отсутствовали и через 24 месяца лечения (р = 0,0006). При этом достоверных различий между уровнем ОККМ через 12 и 24 месяцев не выявлено.
Медиана времени от постановки диагноза до прогрессирования заболевания составила 18 месяцев (в диапазоне от 5 до 81 месяца). Уровень ОККМ в 30 клеток и выше был определен как фактор риска прогрессирования заболевания (р = 0,0002). Наблюдали тенденцию к повышению риска прогрессирования при более высоком уровне ЦОК (р = 0,09). Все больные, с уровнем ОККМ в 30 и более клеток и у которых наблюдали прогрессирование заболевания имели трижды отрицательную форму заболевания, при этом безрецидивная выживаемость составила менее 2 лет.
Представитель SUCCESS Study Group Brigitte K. Rack, MD, из Klinikum der Ludwig-Maximilians-Universitat, Germany, представила результаты исследования ЦОК как фактора риска прогрессирования заболевания и смерти после проведения адъювантной химиотерапии (Abstract 1003).
В исследовании проанализировали образцы периферической крови объемом 23 мл, полученные от 1 503 больных раком молочной железы с метастазами в лимфоузлы или больных раком молочной железы высокого риска без метастазов в лимфоузлы, перед и после проведения адъювантной химиотерапии с использованием таксанов. Медиана времени наблюдения составила 32 месяца.
У 141 больной (9,4%) перед началом системного лечения выявляли ЦОК (более одной клетки), при этом у 130 больных ЦОК выявляли и после проведения химиотерапии (8.7%). У 87 больных возникло прогрессирование заболевания, при этом 33 больных погибли от прогрессирования болезни.
Наличие ЦОК (более одной клетки) перед началом лечения было достоверным фактором риска снижения безрецидивной выживаемости (р < 0,0001) и общей выживаемости (р = 0,003). Достоверно более высокую безрецидивную и общую выживаемость наблюдали в группе больных, у которых при периодическом обследовании ЦОК не определялись, в сравнении с больными у которых при периодическом обследовании выявляли ЦОК (р < 0,0001 и р = 0,002 соответственно).
«Нами установлено прогностическое значение ЦОК в периферической крови больных с ранними формами рака молочной железы до и после химиотерапии. В связи с этим, выявление ЦОК может служить клинически полезным прогностическим маркером и средством мониторинга эффективности лечения. Этот метод требует дальнейшего исследования для определения целесообразности назначения дополнительного (после основной адъювантной терапии) адъювантного лечения в рамках клинических исследований», - заявила доктор Rack.
По мнению Lyndsay N. Harris, MD, из Yale Cancer Center, одной из участниц дискуссии, несмотря на возможную пользу от выявления ЦОК/ОККМ, для применения этого метода в клинической практике необходимы более веские доказательства.
Подготовлено И.Л. Утяшев, Я.Я. Петенко
Нужно ли комбинировать паллиативное лечение и стандартную противоопухолевую терапию?
Дискуссия о целесообразности проведения паллиативной терапии у онкологических больных, получающих основное лечение, ведется давно и в различных странах. Насколько может паллиативная терапия улучшить качество жизни и ее продолжитель-ность? Ведь традиционно паллиативное лечение использовалось исключительно у тяжелых больных, как вариант помощи в хосписах. Целесообразно ли с фармакоэко-номических позиций сочетать проведение основного лечения по поводу заболевания и паллиативной терапии?
В исследовании Jennifer S. Temel et al. изучалось влияние раннего назначения паллиативной терапии у пациентов с метастатическим немелкоклеточным раком легкого (НМРЛ) на качество и продолжительность жизни. 151 пациент был распределен в 2 группы: 1) стандартного лекарственного лечения по поводу НМРЛ и 2) стандартного лекарственного лечения в комбинации с паллиативной терапией. Оценка качества жизни в обеих группах проводилась спустя 12 недель лечения. В течение периода наблюдения 27 пациентов умерло, и окон-чательному анализу подлежало 107 (86%) больных. Группы были сопоставимы по основным характеристикам (возраст, пол, раса, наличие супруга(и), статус по шкале ECOG, наличие метастазов в головной мозг, предшествующее лекарственное лечение, курение, исходный уровень качества жизни и настроения).
Паллиативное лечение влияет на продолжительность жизни
Пациенты, которым проводилась комбинированная терапия, имели статистически значимое улучшение качества жизни по сравнению с больными, получавшими только стандартное лекарственное лечение (р = 0,03). Частота развития депрессии была существенно ниже в группе паллиативной терапии – 16% по сравнению с 38% в группе стандартного лечения (р = 0,01). Общая выживаемость (0В) являлась важным критерием оценки эффективности комбинированного лечения. Медиана 0В была достоверно лучше в группе больных, получавших паллиативную помощь, по сравнению с группой, получавшей только стандартное лечение, и составила 11,6 и 8,9 месяцев соответственно (р = 0,02).
Таким образом, авторы делают вывод, что паллиативная терапия, назначаемая больным НМРЛ на самых ранних этапах лекарственного лечения, представляется целесообразной, так как положительно влияет на настроение пациентов, качество и продолжительность жизни.
J.S. Temel et al. Early palliative care for patients with metastatic non–small-cell lung cancer. N Engl J Med 2010;363:733-42
Возможные пути преодоления резистентности к препаратам платины и паклитакселу
Попытки преодолеть лекарственную устойчивость распространенного рака яичников к химиотерапии на основе паклитаксела и производных платины у некоторых пациентов предусматривали использование третьего препарата в схеме лечения. Гемцитабин рассматривался как один из таких препаратов.
В крупном рандомизированном исследовании с включением 1 742 пациентов сравнивалась эффективность стандартного лече-ния карбоплатином и паклитакселом (ТС) и той же комбинации вместе с гемцитабином (TCG). 882 и 860 больных, ранее не получавших лечение по поводу распространенного рака яичников, были распределены в соответствующие группы. Набор в исследование проходил в 2002-2004 годах.
Результаты исследования
Гематологическая токсичность и утомляемость 3-4 степени чаще наблюдались в группе TCG. Несмотря на то, что частота объективных ответов была выше в группе TCG (86,2% по сравнению с 77,5% в группе ТС, р = 0,0303), это не привело к улучшению результатов выживаемости без прогрессирования (ВВП) и общей выживаемости (0В). Так, медиана ВВП составила 17,8 месяцев для группы TCG и 19,3 месяца для группы ТС (р = 0,0044). Медиана 0В составила 49,5 и 51,5 месяцев соответственно (р = 0,5106).
Добавление гемцитабина к комбинации карбоплатина и паклитаксела не улучшает показатели выживаемости без признаков прогрессирования болезни, а также продолжительности жизни пациентов с распространенный раком яичников, несмотря на достоверное влияние на объем опухолевой массы. В связи с этим клиническое применение комбинации TCG не оправдано.
A. du Bois, et al. Phase III Trial of Carboplatin plus Paclitaxel with or without Gemcitabine in first-line treatment of Epithelial Ovarian Cancer.J Clin Oncol 28:4162-69
Анализ результатов нескольких исследований позволяет рекомендовать маммографию в качестве метода скрининга рака молочной железы в группе женщин 40-49 лет. Скрининг позволяет выявить рак на ранних стадиях, быстро начать лечение, снизить смертность от заболевания. Однако значение скрининга в группе женщин с семейной историей рака молочной железы изучено не до конца.
Целью исследования FH01 явилось изучение роли скрининга в группе женщин моложе 50 лет, в семье которых были зафиксированы случаи рака молочной железы. Набор в данное исследование проходил в 76 центрах Великобритании. Женщины моложе 50 лет с промежуточным семейным риском рака молочной железы ежегодно посещали врача и выполняли маммографию. Выявление мутации гена BRCA не относилось к критериям исключения, однако, частота мутаций в когорте исследуемых была крайне низкой.
В контрольной группе скрининг не проводился. В эту группу вошли женщины с промежуточным риском, которые ранее участвовали в исследовании UK Age Trial (106 971 человек, возраст 40-42 года, наблюдение в течение 10 лет) и Голландском исследовании (возраст 25-77 лет).
Основными критериями оценки эффективности скрининга являлись размер выявленной опухоли, наличие метастазов в лимфа-тических узлах и степень злокачественности инвазивных опухолей.
Результаты исследования
Результаты опубликованы в декабрьском номере журнала Lancet Oncology. 6 710 женщин были включены в исследование за период 2003-2007 г. В среднем каждая женщина проходила маммографию ежегодно в течение 4 лет. У 136 женщин обнаружен рак молочной железы: у 105 (77%) - по результатам маммографии, у 28 (21%) - в промежутке между проведением маммографии на основании жалоб и симптомов, у 3 (2%) - на основании жалоб и симптомов после неудачной последней маммографии. Выявленные инвазивные опухоли в настоящем исследовании были достоверно меньшего размера (р = 0,0094), более благоприятной степени злокачественности (р = 0,0072) и реже сопровождались метастазами в лимфатические узлы (р = 0,0083) по сравнению с контрольной группой UK Age Trial, а также реже сопровождались метастазами в лимфатические узлы по сравнению с Голландским исследованием (р = 0,012).
Авторы сравнили исследуемую и контрольную группы по риску смерти, а также по ожидаемой продолжительности жизни на основании Ноттингемской прогностической шкалы (НПШ). Медиана значения НПШ была достоверна ниже в группе РН01 по сравнению с контрольной группой исследования UK Age Trial (р = 0,00079) и Голландского исследования (р < 0,0001). Ожидаемая 10-летняя смертность также была достоверно (р = 0,022) ниже в исследуемой группе (1,1%) по сравнению с группой контроля UK Age Trial (1,38%).
Ежегодное выполнение маммографии женщинам моложе 50 лет, в семье которых были случаи рака молочной железы, является эффективной мерой, направленной на снижение смертности от заболевания.
FH01 collaborative teams, Lancet Oncology 2010;12:1127-34
Поддерживающая терапия ритуксимабом на 50% снизила риск развития рецидива больных фолликулярной лимфомой, ответивших на индукционное лечение химиотерапией в комбинации с ритуксимабом. Эти данные были получены при предварительном анализе международного исследования III фазы PRIMA (Primary Rituximab and Maintenance), в котором сравнивались применение поддерживающей терапии ритуксимабом и наблюдение. Поддерживающая терапия характеризовалась низкой токсичностью и хорошей переносимостью.
Фолликулярная лимфома является второй по распространенности лимфомой. Несмотря на медленное развитие заболевания и хорошие результаты лечения, достигнутые в эру иммунохимиотерапии, фолликулярная лимфома в большом проценте случаев остается неизлечимой. Большой проблемой в лечении фолликулярной лимфомы является борьба с рецидивами заболевания. Исследование PRIMA было инициировано на основании предшествующих работ, показавших, что поддерживающая терапия ритуксимабом может улучшить результаты лечения больных первичной или рецидивной фолликулярной лимфомой.
В исследование было включено 1 217 больных III-IV стадиями фолликулярной лимфомы с большой опухолевой массой. Все больные были старше 18 лет и не получали ранее лечения. Индукционное лечение включало ритуксимаб плюс CHOP (циклофосфамид, доксорубицин, винкристин, преднизолон; 75%), CVP (циклофосфамид, винкристин, преднизолон; 22%) или FCM (флударабин, циклофосфамид, митоксантрон; 3%). Больные, ответившие на индукционное лечение (n = 1 018) рандомизировались для получения поддерживающей терапии ритуксимабом каждые два месяца на протяжении 2 лет или наблюдения.
При медиане наблюдения 25 месяцев, что было сроком первого предварительного анализа, выживаемость без прогрессирования в группе ритуксимаба составила 82% в сравнении с 66% в группе наблюдения. Различия были достоверны (р < 0,0001).
Положительные результаты были также получены по дополнительным показателям. Риск начала проведения терапии 2 линии был снижен на 39%. Аналогичные результаты были получены во всех подгруппах больных, вне зависимости от возраста, исходной распространенности заболевания или полученной индукционной терапии.
Поддерживающая терапия ритуксимабом характеризовалась удовлетворительной переносимостью. Нежелательные явления III-IV степени чаще отмечались в группе ритуксимаба (23% vs. 16% соответственно), инфекционные осложнения также чаще встречались у больных, получавших поддерживающее лечение (37% vs. 22% соответственно). Качество жизни в группах больных не отличалось.
Для подтверждения влияния поддерживающей терапии ритуксимабом на снижение риска рецидива лимфомы по мнению исследователей требуется продолжение наблюдения. Однако уже на сегодня можно сказать, что данные этого исследования дают основания для разработки новых стандартов лечения больных фолликулярной лимфомой. По сообщению Американского общества клинической онкологии, на основании предварительных данных исследования PRIMA производители ритуксимаба обратились за рекомендацией к применению поддерживающей терапии ритуксимабом у этой популяции больных в США и Европе.
Salles GA, Seymour JF, Feugier P, et al: Rituximab maintenance for 2 years in patients with untreated high tumor burden follicular lymphoma after response to immunochemotherapy. 2010 ASCO Annual Meeting. Abstract 8004.
До недавних пор системное лечение метастатического почечно-клеточного рака (ПКР) было ограничено применением цитокинов и клиническими испытаниями новых препаратов. Несмотря на то, что цитокины были стандартом лечения на протяжении 15 лет, в последнее время в рамках первой и второй линии терапии применяют таргетные препараты – ингибиторы тиро-зинкиназ и моноклональные антитела.
Таргетная терапия является одним из новых направлений лекарственного лечения метастатического ПКР. Основываясь на изучении путей развития опухолевой клетки на молекулярном уровне, создаются препараты, целенаправленно останавливающие тот или иной патогенетический механизм. Сейчас проводится большое количество исследований эффективности таргетных препаратов. Результатом многоцентровых исследований в Европе, США, России явилось внедрение в ежедневную практику онколога новых многообещающих лекарственных средств. К текущему моменту 6 препаратов были одобрены в Российской Федерации, пять из них изучались в первой линии терапии: сунитиниб, сорафениб, темсиролимус, пазопаниб и бевацизумаб в комбинации с интерфероном.
Результаты рандомизированных исследований свидетельствуют об эффективности различных таргетных препаратов в первой линии терапии метастатического ПКР (см. таблицу ниже).
Таблица. Эффективность таргетных препаратов в первой линии по сравнению с ИФН
или плацебо в рандомизированных исследованиях
| Исследование | Медиана ВБП, месяцы | Медиана ОВ, месяцы | Частота ответов, % |
|---|---|---|---|
| Сунитиниб vs ИФН | 11 5,1 P < 0,001 |
26,4 21,8* P = 0,051 |
47 12 P < 0,001 |
| Бевацизумаб+ИФH vs ИФН (AVOREN) | 10,2 5,4 p = 0,0001 |
23,3 21,3 p = 0,1291 |
31 13 p = 0,0001 |
| Бевацизумаб+ИФН vs ИФН (CALGB 90206) |
8,5 5,2 p < 0,0001 |
18,3 17,4 p = 0,097 |
25,5 13,1 p < 0,0001 |
| Сорафениб vs ИФН | 5,7 5,6 p = NA, отличий нет |
NA | 5 9 p = NA, отличий нет |
| Темсиролимус vs ИФН** | 5,5 3,1 p < 0,001 |
10,9 7,3 p = 0,008 |
8,6 4,8 p = NA, отличий нет |
| Пазопаниб vs Плацебо | 11,1 2,8 p < 0,0001 |
Не достигнута | 30*** 3 p < 0,001 |
ИФН – интерферон альфа, ВПБ – выживаемость без прогрессирования, ОВ – общая выживаемость, NA – данных нет
* ОВ для всех пациентов получавших ИФН, включая тех, кто при прогрессировании болезни на ИФН был переведен в группу сунитиниба
** Эффективность препаратов в исследовании изучалась только в группе пациентов с плохим прогнозом
*** Частота ответов в общей группе пациентов
NCCN Clinical Practice Guidelines in Oncology, Kidney Cancer, version 1, 2011. Официальный сайт Росздравнадзора
В последние десятилетия интенсивно изучаются возможности одновременной и/или последовательной лучевой и лекарственной терапии больных плоскоклеточным раком головы и шеи. В литературе описываются 4 основных варианта химиолучевой терапии (ХЛТ): индукционная, индукционно-одновременная, одновременная и адъювантная ХЛТ.
В течение 1998-2007 гг. в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России были пролечены 258 больных плоскоклеточным раком глотки III-IV стадий. В зависимости от методики лечения больные распределены на 3 группы: индукционная (n=68), индукционно-одновременная (n=106) и одновременная химиолучевая (n=84) терапия. В качестве химиотерапии авторы использовали 2 лекарственных препарата: 5-фторурацил и цисплатин. Е 1,2,3 и 4-й дни вводили 5-фторурацил по 1000 мг/м2 каждые 24 ч, в режиме непрерывной инфузии – в течение 96 ч, цисплатин – в дозе 100 мг/м2, внутривенно капельно в 4-й день.
Лучевую терапию проводили на линейном ускорителе по 2 Гр ежедневно до суммарной очаговой дозы 68-72 Гр в режиме расщепленного курса.
Общая и безрецидивная 5-летняя выживаемость в зависимости от варианта химиолучевой терапии составила 38,5 и 53,3% (индукционная химиолучевая терапия), 54,3 и 56,1% (индукционно-одновременная химиолучевая терапия), 56,7 и 64% (одновременная химиолучевая терапия) соответственно.
Авторы делают вывод, что перспективным вариантом химиолучевой терапии местнораспространенного плоскоклеточного рака глотки является индукционно-одновременная и одновременная химиолучевая терапия.
С.Б. Алиева. Пятилетние результаты трех вариантов химиолучевой терапии у больных местнораспространенным плоскоклеточным раком глотки. Вестник ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, т. 21, №3, 2010
Газета Российского общества клинической онкологии – Выпуск 02 • 2011 – Номер подготовлен: И. Тимофеев, Д. Стефанов – Издается 2 раза в месяц. Распространяется бесплатно среди членов общества. Адрес редакции: 119021, Москва, ул. Тимура Фрунзе, 16/3, офис 21-22, тел. (499) 245 50 78, e-mail:
При перепечатке материалов необходимо получить разрешение редакции.