21.03.2017
Микроскопическая вязкость является одним из основных показателей, влияющих на скорость диффузии небольших молекул в полимере, и, как следствие этого, определяющая скорость зависимых от диффузии реакций на микроскопическом уровне. В связи с этим то значение, которое данный параметр играет в процессах жизнедеятельности клеток здорового организма, неоценимо. Его изменение, как на уровне клетки, так и всего организма, приводит к их нарушению и развитию заболеваний [1-7]. Неудивительно, что определение величины микроскопической вязкости на клеточном уровне представляет особую ценность [8]. На сегодняшний день основными методами ее нахождения являются флуоресцентная корреляционная спектроскопия (FCS) [9-11], метод восстановления флуоресценции после фотообесцвечивания (FRAP) [12], метод измерения поляризации флуоресценции или анизотропии [13-15], измерение вязкости с помощью флуоресцентных молекулярных роторов [8, 16]. В настоящее время они широко используются для определения коэффициентов диффузии и вязкости в клетках живого организма и модельных жировых системах. В отличие от других методов, флуоресцентные молекулярные роторы позволяют не только точно измерять вязкость, но и делать это в режиме реального времени [8].
Молекулярные роторы представляют собой малые синтетические флюорофоры, в которых параметры флуоресценции тесным образом зависят от микроскопической вязкости окружающей их среды [8, 16]. Определение флуоресценции с помощью молекулярных роторов позволяет избежать ряд трудностей, связанных с нахождением концентрации неизвестного флюорофора. С их помощью была получена бесценная информация о биологических процессах, происходящих в модельных жировых системах [17-19], бактериальных [20-22] и эукариотических клетках, а также клеточных органеллах [23-33]. Более того, с помощью них была определена микроскопическая вязкость при перекисном окислении липидов [34], гибели клетки [31], спорообразовании бактерий [20-21], а также были оценены изменения вязкости мембраны бактериальной клетки при колебании температуры [22]. Несмотря на это, все вышеперечисленные методы определения вязкости, включая измерение ее с помощью флуоресцентных молекулярных роторов, позволяют оценить ее только in vitro. Вплоть до настоящего времени исследований по определению ее уровня in vivo не было.
Целью совместной работы российских и британских авторов, опубликованной в журнале Scientific Reports (Nature) [40], была разработка метода, позволяющего определить уровень микроскопической вязкости в отдельно взятых злокачественных клетках и тканях у лабораторных мышей in vivo. За основу был взят метод оценки вязкости с помощью флуоресцентных молекулярных роторов.
Спектроскопическая характеристика молекулярных роторов
Роль молекулярных роторов на основе BODIPY (борфторидные комплексы дипирролилметенов) в определении микроскопической вязкости была доказана на примере различных микрогетерогенных систем in vitro. Особое значение для данной работы представляет их использование для оценки вязкости в клеточных органеллах, в том числе в плазматических мембранах клеток живых организмов [8, 29]. Более того, молекулярные роторы на основе BODIPY широко применяются для определения вязкости в режиме реального времени [35]. При проведении данного исследования авторами были выбраны молекулярные роторы BODIPY1 и BODIPY2, эффективность которых была доказана как в модельных системах [17, 19], так и в плазматических мембранах клеток живых организмов [29, 32, 33] (рис. 1).
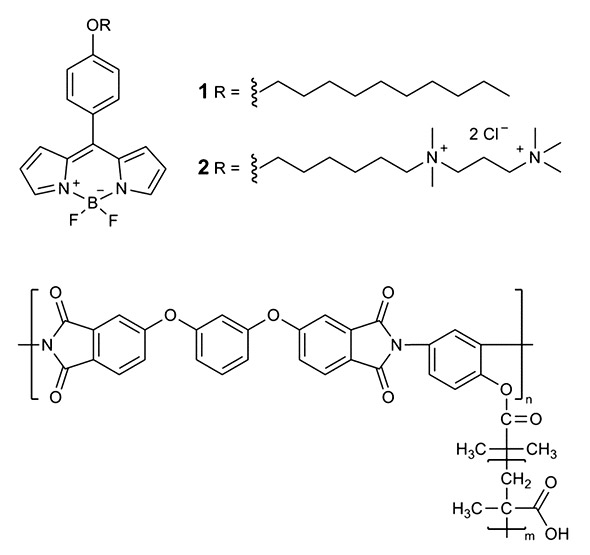
Рисунок 1. Строение молекулярных роторов BODIPY1 и BODIPY2,
а также полимерной щетки, используемой для растворения BODIPY1.
Исследователи отметили, что большинство молекулярных роторов на основе BODIPY являются гидрофобными молекулами (за исключением BODIPY2). В связи с этим для проведения с ними опытов in vivo требуется солюбилизирующий агент. Последнее явилось причиной того, что вначале авторами работы были оценены свойства этих роторов в растворах с высокой концентрацией солюбилизирующих полимерных щеток (строение показано на рисунке 1), эффективность которых была ранее доказана in vivo [36]. Исследователями было выявлено, что через 24 часа при соотношении 1:1 (BODIPY1 : полимерные щетки) происходит полное растворение BODIPY1.
При проведении опытов in vitro авторами были выбраны различные соотношения BODIPY и полимерных щеток: I) BODIPY1 с низкой концентрацией щеток, что позволяло BODIPY1 практически полностью раствориться (10:1); II) BODIPY1 с высокой концентрацией щеток, что позволяло BODIPY1 полностью раствориться; III) раствор BODIPY2 в воде.
Определение микроскопической вязкости в клетках линии CT26 in vitro
Сначала авторы исследования ввели растворы BODIPY1 и BODIPY2 в культивируемые клетки линии CT26 (колоректальный рак) мышей (рис. 2). Во всех клетках была выявлена яркая флуоресценция, характерная для BODIPY. В то время как при соотношении I наблюдалась точечная флуоресценция, при соотношениях II и III была видна четко окрашенная цитоплазматическая мембрана.
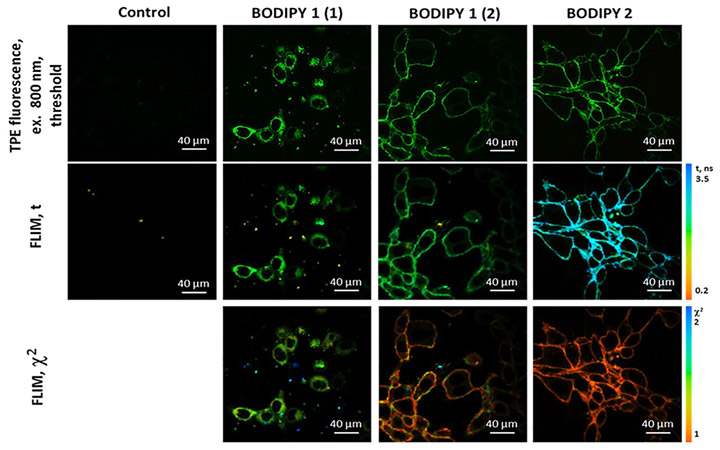
Рисунок 2. Изображения CT26 клеток, выявленные методами двухфотонной (TPE) флуоресценции
и время-разрешенной флуоресцентной микроскопии (FLIM) после инъекции BODIPY1 и BODIPY2.
Во II и III случаях затухание флуоресценции носило моноэкспоненциальный характер, в то время как в I – биэкспоненциальный. Микроскопическая вязкость мембраны в CT26 клетках составила 184±11 cP (II) и 377±27 cP (III) соответственно. Несмотря на то, что роторы BODIPY1 и BODIPY2 занимают одинаковое положение в липидном слое [17], величина вязкости, определяемая BODIPY1, была значительно ниже. Авторами было предположено, что полимерная щеточка повреждает структуры цитоплазматической мембраны, делая ее менее вязкой [37, 38]. Данные особенности должны быть приняты во внимание при интерпретации результатов in vitro и in vivo [39].
Накопление и расход молекулярных роторов in vivo
Убедившись в том, что BODIPY1 и BODIPY2 взаимодействуют с культивируемыми опухолевыми клетками CT26, авторами исследования были изучены процессы их накопления и расход в злокачественных клетках. Учеными было выявлено, что внутривенное введение BODIPY1 без полимерных щеток (8 мг/кг; 5% диметилсульфоксид [ДМСО]) не вызывает появление флуоресценции. Введение водного раствора BODIPY2 (III) и BODIPY1 с низкой концентрацией щеток (I) вызывало флуоресценцию в опухоли, которая в то же время не отражала специфичный характер накопления роторов (рис. 3). При введении BODIPY2 была отмечена максимально выраженная флуоресценция опухоли, сохранявшаяся в течение 15 мин. – 6 часов после инъекции. При введении BODIPY1 наиболее высокий уровень флуоресценции был достигнут через 6 часов после инъекции. Оба ротора оставались в опухоли в относительно высокой концентрации через 24 часа после введения.
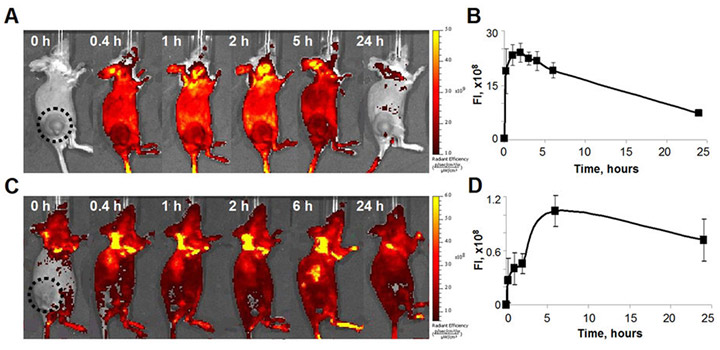
Рисунок 3. Накопление молекулярных роторов BODIPY1 и BODIPY2
в злокачественных клетках CT26 in vivo.
Изображение флуоресценции (А, С) и ее кинетика (B, D) после введения BODIPY2 (A, B) и BODIPY1 (I) (С, D).
При проведении более подробного анализа ex vivo оказалось, что наиболее высокая концентрация роторов была в органах, через которые проходила их экскреция – кишечник, печень и кожа. При введении BODIPY2 в процесс экскреции были также вовлечены почки. Снижение концентрации BODIPY2 в остальных органах и тканях происходило в следующей последовательности: опухоль → легкие → мышцы → сердце → селезенка. Снижение концентрации BODIPY1 происходило в следующей последовательности: мышцы → опухоль → сердце → почки → легкие → селезенка.
При анализе кинетики BODIPY2 и BODIPY1 в плазме крови было выявлено постепенное снижение их концентрации с полной элиминацией из кровотока через 48 часов после инъекции. Необходимо отметить, что введение роторов не сопровождалось развитием острых нежелательных реакций у мышей.
Определение вязкости в злокачественных клетках CT26 in vivo
На следующем этапе авторы исследования получили изображения, определенные методом время-разрешенной флуоресцентной микроскопии (Fluorescence-Lifetime Imaging Microscopy – FLIM) в злокачественных клетках мышей после инъекции BODIPY1 и BODIPY2. Во всех случаях была выявлена яркая двухфотонная флуоресценция и изображения FLIM (рис. 4). После введения BODIPY1 (I) наблюдался биэкспоненциальный распад ротора как в опухоли, так и в окружающей ткани.
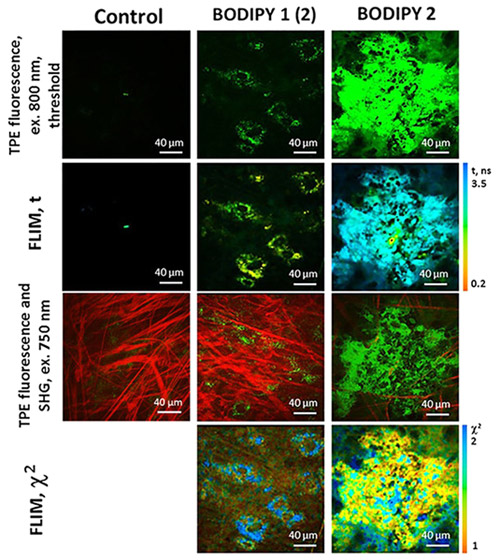
Рисунок 4. Изображения CT26 клеток in vivo, выявленные методами
двухфотонной (TPE) флуоресценции и время-разрешенной флуоресцентной микроскопии (FLIM)
через 40 минут после введения BODIPY1 и через 60 минут после введения BODIPY2.
Интересно, что после введения BODIPY1 (II) наблюдался биэкспоненциальный распад ротора в злокачественных клетках и моноэкспоненциальный – в окружающей ткани.
Для того чтобы убедиться в том, что присутствие полимерных щеток in vivo не влияет на вязкость коллагена, авторы исследования определили время флуоресценции BODIPY1 и BODIPY2 в гидрогелях коллагена in vitro (рис. 5). Оказалось, что после введения BODIPY2 (III) наблюдался биэкспоненциальный распад ротора в коллагене, что соответствовал таковому in vivo. Напротив, после введения BODIPY1 был выявлен моноэкспоненциальный распад (рис. 5). В присутствии полимерных щеток время жизни флуоресценции BODIPY1 составило 2.79±0.15 нс (вязкость 429±51 cP). Без полимерных щеток аналогичные показатели составили 2.22±0.06 нс (260±15 cP). Таким образом, вязкость коллагена может быть определена после введения BODIPY1 in vitro, но не после введения BODIPY2. Более того, по аналогии с культивируемыми клетками, на величину вязкости коллагена in vitro влияло присутствие полимерных щеток. Напротив, последние не оказывали влияние на вязкость окружающих тканей in vivo.
Введение водорастворимого BODIPY2 (III) в хвостовую вену мыши сопровождалось моноэкспоненциальным распадом флуоресценции в опухоли (время испускания флуоресценции составило 2.67±0.06 нс; рис. 4). Показатели, зарегистрированные в клетках опухоли in vivo, соответствовали времени жизни флуоресценции в культивируемых клетках CT26 и значению вязкости, определенной в клетках in vitro (386±19 cP). Вязкость среды не изменялась при измерении ее in vivo в течение 20-80 минут после введения BODIPY2. Значения вязкости, определенные in vivo и in vitro суммированы в табл. 1.
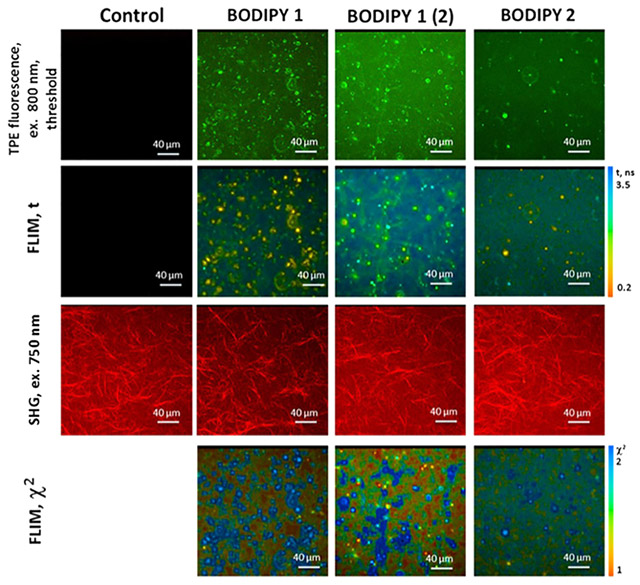
Рисунок 5. Изображения коллагеновых волокон, выявленных методами двухфотонной (TPE) флуоресценции и время-разрешенной флуоресцентной микроскопии (FLIM) после введения BODIPY1 и BODIPY2.
Таблица 1. Показатели вязкости, определенные in vitro и in vivo
с использованием молекулярных роторов BODIPY.
| BODIPY 1 (ДМСО) | BODIPY 1 (I) | BODIPY 1 (II) | BODIPY 2 (III) | |
|---|---|---|---|---|
| IN VITRO | ||||
| Злокачественные клетки | Биэкспоненциальный распад | 1.90±0.05 нс/184±11 cP | 2.64±0.09 нс/377±27 cP | |
| Коллаген | 2.22±0.06 нс/260±15 cP | Не обнаружен | 2.79±0.15 нс/429±51 cP | Биэкспоненциальный распад |
| IN VIVO | ||||
| Злокачественные клетки | Не обнаружен | Биэкспоненциальный распад | Биэкспоненциальный распад | 2.67±0.06 нс/386±19 cP |
| Коллаген | Не обнаружен | Биэкспоненциальный распад | 2.24±0.06 нс/265±16 cP | Биэкспоненциальный распад |
Таким образом, авторами исследования было выявлено, что величина вязкости, определенная в клетках опухоли in vivo, соответствует ее значению in vitro. Новый метод позволил не только измерять вязкость в живых организмах, но и следить за ее изменениями в режиме реального времени. Последнее представляется особенно важным для диагностики и оценки результатов лечения, о которых возможно будет судить по изменениям микроскопической вязкости.
Литература: