17.03.2016
Больные немелкоклеточным раком легкого (НМРЛ), опухоли которых имеют мутацию в структуре гена рецептора эпидермального фактора роста (EGFR), являются высокочувствительными к первой линии терапии с включением ингибиторов тирозинкиназы (ТКИ) EGFR [1]. Как бы то ни было, у большинства пациентов с течением времени развивается резистентность к данным препаратам и, как следствие, прогрессирование заболевания [2]. Существует предположение о том, что на момент прогрессирования часть клеток НМРЛ остается чувствительной к действию ингибиторов тирозинкиназы мутированного EGFR [3]. Клинические наблюдения подтверждают данное предположение и свидетельствуют о том, что отказ от данных препаратов в этот момент может привести к бурному прогрессированию опухолевого процесса [4,5]. В связи с этим рациональным кажется продолжение терапии ими в комбинации с другими противоопухолевыми средствами. Более того, в ряде исследований было показано, что продолжение терапии ингибиторами ТКИ EGFR после прогрессирования заболевания увеличивает выживаемость больных НМРЛ, опухоли которых имеют мутацию в структуре гена EGFR [6,7].
Афатиниб является необратимым ингибитором тирозинкиназы сразу нескольких рецепторов семейства EGFR (erbB1, Her-2/erbB2, erbB4) [8,9]. У больных НМРЛ с активирующей мутацией гена EGFR, не получавших лечение по поводу метастатического процесса, монотерапия афатинибом продемонстрировала преимущество как в отношении выживаемости без прогрессирования (ВБП), так и в отношении общей выживаемости (ОВ) при сравнении со стандартными режимами химиотерапии на основе препаратов платины [10-12]. Более того, препарат обладал умеренной эффективностью при лечении больных с прогрессированием заболевания после терапии гефитинибом
Все больные, вошедшие в исследование LUX-Lung 5, имели IIIb или IV стадии НМРЛ с прогрессированием заболевания после ≥1 линии химиотерапии (с включением платины и пеметрекседа) и эрлотиниба/гефитиниба после ≥12 недель лечения [17]. Помимо этого, пациенты должны были получать афатиниб в монорежиме с клиническим эффектом, продолжающимся ≥12 недель (полный ответ, частичный ответ или стабилизация заболевания), с последующим прогрессированием болезни. Все участники исследования были ≥18 лет и находились в удовлетворительном общем состоянии – статус по шкале ECOG 0-2. Ожидаемая продолжительность жизни пациентов составляла ≥12 недель. Критериями исключения являлись отсутствие клинического эффекта на монотерапии афатинибом, а также нарушения функции печени и почек, не совместимые с проводимой терапией.
Пациенты были рандомизированы в соотношении 2:1 в две группы, первая из которых получала афатиниб (40 мг × 1 р/день ежедневно) и паклитаксел (80 мг/м2 в/в кап. еженедельно), а вторая – выбранный на усмотрение исследователя химиопрепарат в монорежиме. При рандомизации учитывались продолжительность терапии гефетинибом/афатинибом (≥6 или <6 месяцев) и пол пациента. Лечение проводилось до прогрессирования заболевания, развития непереносимой токсичности или отказа пациента от участия в исследовании.
Основным критерием эффективности был показатель ВБП. Помимо этого оценивались частота объективного ответа (ЧОО), ОВ и токсичность.
Исследование было проведено в 115 центрах 23 стран мира. С апреля 2010 г. по май 2011 г. 1154 пациента получили афатиниб в монорежиме (часть А). Из них 202 пациента с клиническим эффектом, продолжавшемся не менее 12 недель, были рандомизированы в часть B исследования (134 получали афатиниб + паклитаксел и 68 – химиотерапию в монорежиме).
По результатам данного исследования медиана ВБП в группе больных, получавших афатиниб с паклитакселом, была значительно выше, чем в группе больных, находившихся только на химиотерапии (5,6 и 2,8 месяцев соответственно, ОР 0,60, 95% ДИ 0,43–0,85, p=0,003). В зависимости от того, какой препарат получали пациенты из второй группы (паклитаксел, пеметрексед или другой цитотоксический препарат), медиана ВБП составила 3,8 (n=21), 2,9 (n=16) и 2,1 (n=23) месяца соответственно. Результаты представлены на рисунке 1A.
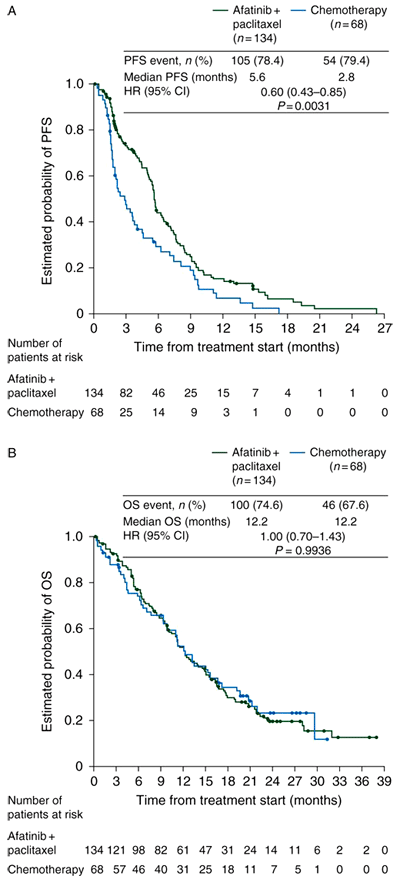
Рисунок 1. Выживаемость без прогрессирования (А) и общая выживаемость (B) в исследовании LUX-Lung 5.
Показатель ЧОО был также выше в группе больных, получавших афатиниб с паклитакселом (32,1% и 13,2% соответственно; ОР 3,41, 95% ДИ 1,41–6,79, p=0,005).
Разницы в показателе ОВ между сравниваемыми группами выявлено не было (12,2 и 12,2 месяцев соответственно, ОР 1,00, 95% ДИ 0,70–1,43, p=0,994). Результаты представлены на рисунке 1B.
Медиана продолжительности лечения в группе, получавшей афатиниб с паклитакселом, составила 133 дня, тогда как в контрольной группе – 51 день.
Нежелательные явления 3-4 степени чаще встречались в группе больных, получавших два препарата (48,5% и 30% соответственно). Из нежелательных явлений в первой группе чаще всего наблюдались диарея (53,8%), алопеция (32,6%), астения (27,3%), снижение аппетита (22%) и кожная сыпь (20,5%). Частота встречаемости периферической нейропатии между группами больных, получавших два препарата и один препарат, составила 9,1% и 8,3% соответственно. В целом профиль безопасности препаратов соответствовал изученному ранее.
Авторы исследования сделали вывод о том, что по сравнению с химиотерапией в монорежиме комбинация афатиниба с паклитакселом увеличивает показатели ВБП и ЧОО у больных с развившейся резистентностью на терапии эрлотинибом/гефитинибом и прогрессированием заболевания на афатинибе после зарегистрированного ранее клинического эффекта. Данное исследование является первой проспективной работой, продемонстрировавшей преимущество продолжения терапии ингибиторами ТКИ EGFR после прогрессирования заболевания по сравнению со стандартной химиотерапией.
Литература: