01.10.2014
Дата: 28 сентября 2014 г.
Тема: Рак молочной железы / Противоопухолевые агенты и биотерапия
На конгрессе ESMO 2014, проходившем в Мадриде, Испания, в рамках сессии по раку молочной железы (представленные публикации) исследователи показали результаты рандомизированных клинических исследований III фазы IMELDA и TANIA при HER2-негативном метастатическом раке молочной железы. В исследовании IMELDA добавление капецитабина к поддерживающей терапии бевацизумабом привело к статистически и клинически значимому улучшению выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ). Также была достигнута первичная цель исследования TANIA, показавшего статистически значимое улучшение ВБП на фоне поддерживающей терапии бевацизумабом после прогрессирования на терапии первой линии с добавлением бевацизумаба.
Улучшение результатов химиотерапии первой линии с помощью поддерживающей терапии может влиять на показатели ОВ. Комбинация бевацизумаба с химиотерапией первой линии значительно улучшает ВБП у пациентов с HER2-негативным местно рецидивирующим/метастатическим раком молочной железы. Преимущество бевацизумаба наиболее выражено при комбинированной терапии с таксанами. Кумулятивная токсичность не позволяет продолжать терапию таксанами до наступления прогрессирования заболевания.
До отмены регистрационного статуса режима бевацизумаб/доцетаксел в 2011 году эта комбинация считалась целесообразной опцией для первой линии терапии HER2-негативного метастатического рака молочной железы, обоснованием этому служили результаты исследования III фазы. При добавлении поддерживающей терапии бевацизумабом до наступления прогрессирования заболевания после максимум 9 курсов химиотерапии первой линии препаратом доцетаксел было отмечено значительное улучшение показателей ВБП и частоты ответов (ЧО) на лечение.
В открытом рандомизированном исследовании III фазы IMELDA оценивалась целесообразность переключения пациентов, продолжающих терапию ингибиторами VEGF, на менее токсичный режим химиотерапии с другим механизмом действия с целью обеспечения большей эффективности поддерживающей терапии. Предполагалось, что после исходного режима бевацизумаб/доцетаксел добавление капецитабина к поддерживающей терапии бевацизумабом, продолжающейся до наступления прогрессирования заболевания, поможет улучшить ВБП. Результаты исследования были представлены доктором Joseph Gligorov из отделения медицинской онкологии Университетской больницы Тенона, Париж, Франция.
В исследование включали пациентов с HER2-негативным измеряемым метастатическим раком молочной железы с общим статусом по шкале ECOG<2, ранее не получавших химиотерапию.
После 3-6 курсов терапии бевацизумабом/доцетакселом пациенты без прогрессирования заболевания были рандомизированы в группу монотерапии бевацизумабом или группу комбинированной терапии бевацизумабом/капецитабином; лечение продолжалось до наступления прогрессирования заболевания. Стратификация проводилась по следующим факторам: статус рецепторов эстрогена (РЭ), наличие висцеральных метастазов, ответ на лечение и концентрация ЛДГ.
Первичной конечной точкой исследования был показатель ВБП с момента рандомизации до наступления прогрессирования/летального исхода; вторичная конечная точка включала ЧО, частоту клинических улучшений, время до прогрессирования заболевания, ОВ с момента рандомизации, безопасность и качество жизни. Размер выборки был рассчитан с учетом относительного риска (ОР) ВБП, равного 0,70, и медианы улучшения ВБП от 5,8 до 8,3 месяца. В общей сложности в исследование были включены 360 пациентов, рандомизированы 290 человек. Планировалось, что 244 события ВБП обеспечат 80% статистическую мощность при 5% ошибке первого рода (α). Исследование не было спланировано для прямого сравнения ОВ.
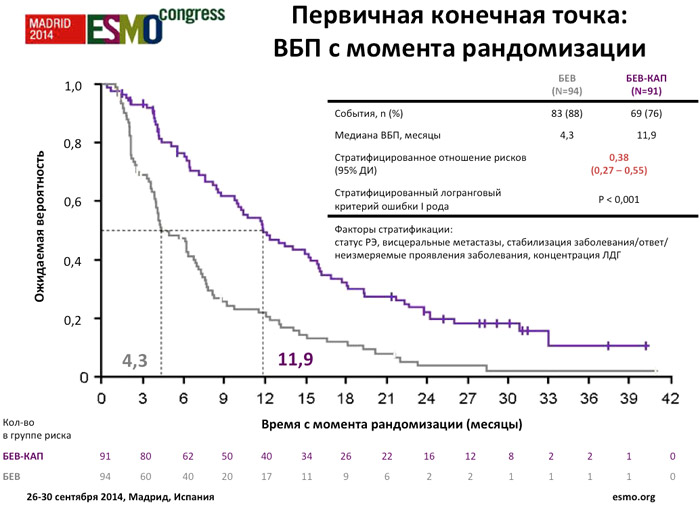
За период с июня 2009 по март 2011 года, когда включение пациентов в исследование было досрочно завершено, 287 пациентов были включены в исследование и 284 из них получили лечение; 185 пациентов (65%) полностью получили исходное лечение и были последовательно рандомизированы в группы поддерживающей терапии. В протокол было внесено изменение: продление периода наблюдения до 2 лет после рандомизации последнего пациента.
Медиана возраста в группе бевацизумаба составила 54 года, в группе бевацизумаб/капецитабин – 49 лет. Тройной негативный фенотип рака молочной железы был выявлен у 22% пациентов, включенных в группу бевацизумаба, и у 27% пациентов в группе бевацизумаб/капецитабин. Частота висцеральных метастазов в обоих группах была практически идентична (69% vs 68%), однако на момент включения в начальную фазу исследования в группе бевацизумаба чаще отмечались метастазы в ≥3 органах (57% vs 47%).
Результаты исследования IMELDA
Среди пациентов, получавших поддерживающую терапию, медиана продолжительности лечения была выше в группе бевацизумаб/капецитабин (8,3 vs 3,5 месяцев). Добавление капецитабина к поддерживающей терапии бевацизумабом обеспечивает статистически и клинически значимое улучшение ВБП с момента рандомизации (ОР 0,38; р<0,001; медиана 11,9 vs 4,3 месяца) и эксплораторном анализе (ВБП с момента начала терапии первой линии), а также увеличение медианы ОВ с момента рандомизации (ОР 0,42; р<0,001; медиана 39 vs 23,3 месяца), несмотря на меньшую чем планировалось выборку пациентов в виду досрочного завершения периода включения в исследование. Однако на момент составления отчета продолжительность периода наблюдения ОВ была недостаточной, с низкой частотой событий.
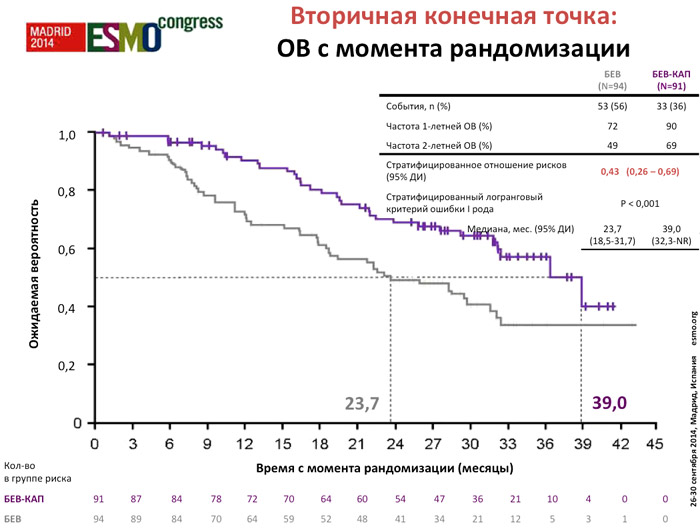
Было отмечено управляемое увеличение нежелательных явлений, главным образом, ввиду развития ладонно-подошвенного синдрома у 33% пациентов в группе бевацизумаб/капецитабин. Гипертензия была отмечена у 9% пациентов в группе комбинированной терапии и у 3% в группе монотерапии бевацизумабом. Частота развития протеинурии была одинаковой (4%) в обеих группах. Гастроэнтерит был зарегистрирован у 3 пациентов в группе монотерапии бевацизумабом.
Выводы исследования IMELDA
Доктор Gligorov сделал вывод, что у пациентов, получивших пользу от терапии первой линии с добавлением бевацизумаба, продолжение поддерживающей терапии бевацизумабом в комбинации с капецитабином улучшает эффективность лечения. Продолжается оценка эффективности, которая предусматривает сбор данных о противоопухолевой терапии, назначенной после исследуемых режимов, а также результаты лечения по данным опроса пациентов.
Доктор Hope Rugo, который участвовал в обсуждении результатов исследования, прокомментировал, что в исследовании IMELDA была предпринята попытка ответить на вопрос: может ли продолжение терапии бевацизумабом после наступления прогрессирования заболевания оказывать влияние на его исход? Доктор Rugo поставил под вопрос эффективность поддерживающей терапии бевацизумабом после ответа на химиотерапию первой линии. В исследовании было отмечено: увеличение продолжительности лечения в группе капецитабин/бевацизумаб по сравнению с монотерапией бевацизумабом (в два раза больше курсов терапии); существенное увеличение ВБП, показатель ВБП с момента начала терапии первой линии был в два раза выше; ОВ была значительно выше, но также почти в два раза выше была токсичность >3 степени тяжести (главным образом, ладонно-подошвенный синдром, гипертензия, но также и тромбоэмболии). Развитие ладонно-подошвенного синдрома привело к прекращению терапии капецитабином у 10% пациентов.
В рамках рандомизированных клинических исследований III фазы было показано, что добавление бевацизумаба к химиотерапии первой или второй линии значительно улучшает ВБП при HER2-негативном местно рецидивирующем/метастатическом раке молочной железы. Поддерживающая блокада VEGF может иметь значение для длительного контроля над заболеванием. В открытом рандомизированном исследовании III фазы TANIA оценивали дальнейшую терапию бевацизумабом у больных местно рецидивирующим/метастатическим раком молочной железы, ранее получавших лечение данным препаратом. Результаты исследования были представлены Gunther von Minckwitz, генеральным директором Немецкой группы по изучению заболеваний молочной железы (German Breast Group) и университетской клиники женского здоровья в Ной-Изенбурге, Германия.
Пациенты с HER2-негативным местно рецидивирующим/метастатическим раком молочной железы, у которых было выявлено прогрессирование заболевания во время/после ≥12 недель первой линии терапии бевацизумабом в комбинации с химиотерапией, были рандомизированы в соотношении 1:1 в группы химиотерапии второй линии с добавлением бевацизумаба или без (15 мг/кг каждые 3 недели или 10 мг/кг каждые 2 недели).
Факторами стратификации были: статус гормональных рецепторов; время до прогрессирования на терапии первой линии (<6 vs ≥6 месяцев); режим химиотерапии (с таксанами vs без таксанов vs винорельбин); концентрация ЛДГ (≤1,5 vs >1,5 × верхние границы нормы).
Вторая линия терапии продолжалась до наступления прогрессирования заболевания, неприемлемой токсичности или отказа от дальнейшего участия в исследовании. В группе химиотерапии, при наступлении прогрессирования заболевания, пациенты получали третью линию химиотерапии без добавления бевацизумаба (не проводился кроссовер); пациенты, исходно рандомизированные в группу химиотерапии в комбинации с бевацизумабом, при наступлении прогрессирования получали химиотерапию третьей линии и бевацизумаб.
Выбор режима химиотерапии проводился на основании предпочтений исследователя, но двойные комбинации не допускались: паклитаксел, наб-паклитаксел, доцетаксел, капецитабин, гемцитабин, пегилированный липосомальный доксорубицин, непегилированный липосомальный доксорубицин, доксорубицин, эпирубицин, винорельбин, циклофосфамид, иксабепилон и эрибулин (только для терапии третьей линии).
Первичной конечной точкой исследования являлась ВБП от момента рандомизации до второго прогрессирования заболевания/летального исхода. Дополнительные конечные точки включали: ВБП на фоне терапии второй линии в предварительно определенных подгруппах, ВБП на фоне терапии второй и третьей линии, рассчитанную от момента рандомизации до третьего прогрессирования заболевания/смерти, частоту объективных ответов на терапию второй линии; ОВ; безопасность; качество жизни и биомаркеры.
Размер выборки был рассчитан на основании предполагаемой медианы продолжительности ВБП 7-9,3 месяца и ОР 0,75. События ВБП, достигнутые у 384 из 488 пациентов, обеспечивают 80% статистическую мощность исследования при ошибке первого рода α = 0,05.
Результаты исследования TANIA
На конгрессе ESMO 2014 исследователи представили результаты предварительного анализа ВБП на фоне терапии второй линии. Конечные точки в отношении терапии третьей линии будут представлены в заключительном анализе.
За период с января 2011 по апрель 2013 года в исследование были включены 494 пациента (247 человек в группу химиотерапии и 247 – в группу химиотерапии с добавлением бевацизумаба). Исходные характеристики пациентов были сопоставимы в группах химиотерапии vs химиотерапия в комбинации с бевацизумабом: медиана возраста 54 vs 56 лет; тройной негативный фенотип 23,1% vs 19,8%; период без проявлений заболевания ≤12 месяцев 9,7% vs 7,3%.
Капецитабин наиболее часто становился препаратом выбора для терапии второй линии: 59,7% в группе химиотерапии и 60,4% в группе химиотерапии с добавлением бевацизумаба.
Медиана периода наблюдения была сопоставима в обеих группах. На момент закрытия базы данных 20 декабря 2013 года медиана ВБП на фоне терапии второй линии составила 4,2 месяца в группе химиотерапии и 6,3 месяца в группе химиотерапии с добавлением бевацизумаба (стратифицированное ОР=0,75; p=0,0068). Подгрупповой анализ ВБП с учетом факторов стратификации также оказался более благоприятным для группы бевацизумаб/химиотерапия.
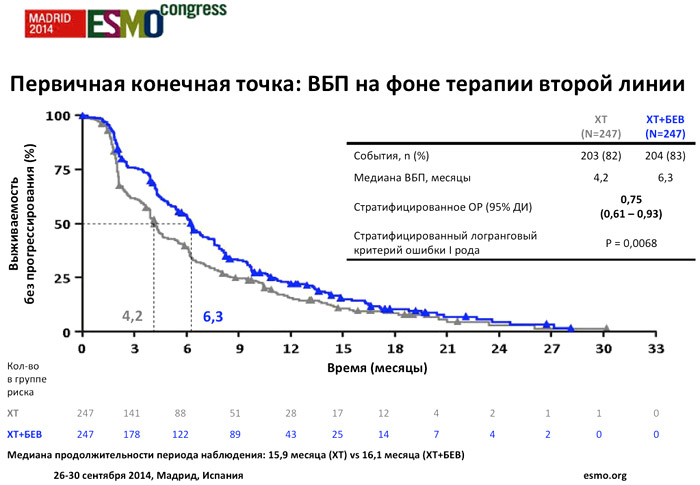
Не было отмечено статистически значимой разницы между двумя группами в отношении частоты наилучших объективных ответов (16,8% vs 20,9%). Однако стабилизация заболевания была зарегистрирована у 33,5% пациентов в группе химиотерапии и у 48,9% пациентов в группе бевацизумаб/химиотерапия.
Медиана продолжительности ответа составила 10,6 vs 8,3 месяца для пациентов, получавших химиотерапию или бевацизумаб в комбинации с химиотерапией.
Частота побочных эффектов была незначительно выше в группе, получавшей бевацизумаб в комбинации с химиотерапией:
Выводы исследования TANIA
Исследователи заключили, что была достигнута первичная конечная точка исследования, показав статистически значимое улучшение ВБП на фоне поддерживающей терапии бевацизумабом после прогрессирования заболевания на терапии первой линии с добавлением бевацизумаба. Данные по безопасности терапии второй линии соответствовали результатам предыдущих исследований бевацизумаба при местно рецидивирующем/метастатическом раке молочной железы. Заключительные данные ОВ и ВБП с момента рандомизации до прогрессирования на терапии третьей линии/летального исхода, а также результаты по безопасности терапии третьей линии ожидаются к середине 2015 года.
Доктор Hope Rugo, который также участвовал в обсуждении результатов данного исследования, прокомментировал, что в исследовании TANIA была предпринята попытка выяснить влияние химиотерапии по сравнению с таргетной монотерапией в качестве поддерживающей терапии после ответа на лечение. Фактически 85% пациентов получали таксаны в первую линию химиотерапии (73% паклитаксел). Была отмечена необычайно высокая ВБП на фоне терапии первой линии. Почти 60% пациентов получали капецитабин во вторую линию. ВБП была выше на фоне поддерживающей терапии бевацизумабом; также было отмечено увеличение частоты стабилизации заболевания, но не ЧОО и, как и в предшествующих исследованиях, наибольшее преимущество было отмечено у больных с тройным-негативным фенотипом рака молочной железы.
Кроме того, терапия бевацизумабом сопровождалась более тяжелой токсичностью (гипертония, протеинурия, нейтропения).
Поддерживающая химиотерапия улучшает ВБП и ОВ после ответа на химиотерапию первой линии. Неясные дополнительные преимущества бевацизумаба должны быть сбалансированы с затратами на лечение и токсичностью. Не следует назначать монотерапию бевацизумабом в качестве поддерживающей терапии у данных пациентов. Примерно у 75% больных отмечается положительный статус гормональных рецепторов, что указывает на возможную роль поддерживающей гормональной терапии.
Доктор Rugo заключил, что на сегодняшний день роль бевацизумаба в лечении рака молочной железы неясна.
Примечание
После презентации на конгрессе ESMO 2014 результаты исследований IMELDA и TANIA будут опубликованы в журнале Lancet Oncology.
Ссылки
Спонсором клинических исследований IMELDA и TANIA является компания Ф. Хоффманн-Ля Рош.