Р.Фостер
Indiana University, Indianapolis, USA
После радикальной орхофуникулэктомии пациентам с герминогенной опухолью яичка необходимо определить стадию заболевания. Для этого требуется выполнить компьютерную томографию (КТ) органов грудной и брюшной полостей и определить уровень АФП и ХГ. Если по данным КТ в органах грудной клетки и брюшной полости не обнаружено патологии, а уровень ХГ и АФП нормализовался после орхофуникулэктомии, устанавливается I стадия заболевания. Время полужизни для ХГ составляет от 1до1,5 дней и для АФП - 4-5 дней соответственно.
Приблизительно 30% пациентов с I стадией заболевания в действительности имеют микроскопические метастазы, не определяемые при КТ или с помощью маркеров [1]. У подавляющего большинства таких пациентов эти метастазы локализуются в забрюшинном пространстве, причем, как правило, с той стороны, где располагалась первичная опухоль в яичке [2]. Например, метастатические отсевы из правого яичка обычно обнаруживаются в аортокавальном промежутке или прекавальной зоне, для левосторонней опухоли яичка характерны микроскопические отсевы в левой периаортальной зоне.
Одним из вариантов лечения таких пациентов является нервосберегающая забрюшинная лимфаденэктомия (ЗЛАЭ). Выполнение операции позволяет быстро установить истинную стадию заболевания и соответственно ей избрать правильную тактику лечения. Выполнение операции приводит к излечению 50-75% больных с метастазами в забрюшинные лимфоузлы. Этим достигается лучший психологический комфорт пациентов, знающих точную стадию заболевания и получающих соответственное лечение или наблюдение [3,4]. Известно также, что прогрессирование болезни после ЗЛАЭ происходит в ближайшие 2 года, что сокращает срок необходимого наблюдения и делает его более простым методически. Кроме того, накоплен большой клинический опыт выполнения нервосохраняющих ЗЛАЭ, что существенно уменьшило частоту послеоперационных нарушений эякуляции.
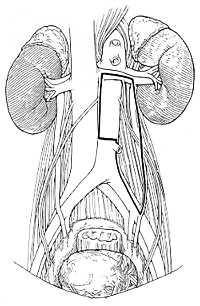
Так как локализация метастазов в забрюшинном пространстве зависит от расположения первичной опухоли, для право- и левосторонних опухолей яичка используют различные варианты доступа (рис.1). Все лимфатические узлы удаляются через эти доступы. Для того чтобы сохранить мочеиспускание и эякуляцию эфферентные симпатические стволы, проходящие в этих зонах, вначале отделяются от лимфатических узлов, после чего производится полное удаление лимфоидной ткани. При проведении односторонней нервосохраняющей операции все пациенты в дальнейшем имеют нормальную эякуляцию.
Сохраняя эякуляцию и уменьшая необходимость в проведении химиотерапии, ЗЛАЭ тем самым сохраняют способность к оплодотворению у большинства больных. Так как выполнение ЗЛАЭ приводит к излечению 50-75% пациентов со II стадией, для них отпадает необходимость проведения химиотерапии. Хотя эффективность и осложнения ЗЛАЭ в сравнении с химиотерапией у больных II стадией являются предметом оживленной дискуссии, нельзя не признать факт негативного влияния химиотерапии на сперматогенез в оставшемся яичке.
Большинство больных хорошо переносят выполнение ЗЛАЭ. По данным Университета Индианы, пациенты госпитализируются на 3-5 дней и окончательно поправляются в течение 3-6 недель. Единственным серьезным побочным эффектом этой операции является развитие тонкокишечной непроходимости у 1% пациентов и у стольких же больных возможно развитие грыжи в области послеоперационного рубца [5]. Техника операции позволяет избегать переливаний крови.
Таким образом, нервосохраняющая ЗЛАЭ является методом выбора для многих пациентов с I стадией несеминомной герминогенной опухоли яичка. Эти операции клинически обоснованы и необходимы для установления точной стадии заболевания. Другими преимуществами операции для пациента являются психологический комфорт (нет необходимости ожидать рецидива), короткий период динамического наблюдения, возможность избежать многих побочных эффектов химиотерапии, включая потерю фертильности.
Технические особенности операций.
Правосторонняя нервосохраняющая модифицированная ЗЛАЭ. Операционный доступ - срединная лапаротомия, с использованием ранорасширителя. Рассекается задний париетальный листок брюшины от слепой кишки вверх до связки Трейца. Корень брыжейки тонкой кишки и восходящей ободочной кишки отводятся с передней поверхности аорто-кавальной зоны и полой вены и фиксируется с помощью ранорасширителя. В случае отсутствия увеличенных лимфоузлов выполняется правосторонняя диссекция как на схеме 1. Лимфатическая ткань рассекается на передней поверхности аорты от уровня пересечения с левой почечной веной до уровня нижней брыжеечной артерии. Эта ткань отслаивается от боковой поверхности аорты и смещается в аорто-кавальную зону, чтобы одновременно убедиться в отсутствии дополнительных артерий к нижнему полюсу правой почки. Затем подобное рассечение лимфатической ткани на 12 часах выполняется над нижней полой веной от уровня левой почечной вены дистально до пересечения правой общей подвздошной артерии. Правая яичковая вена пересекается в области своего впадения в нижнюю полую вену и затем мобилизуется до внутреннего пахового кольца. На этом уровне семявыносящий проток пересекается между лигатурами, и культя семенного канатика, оставшаяся после орхофуникулэктомии, удаляется из внутреннего пахового кольца. Первый препарат правой яичковой вены и культя семенного канатика посылаются на гистологическое исследование. Далее диссекция продолжается на полой вене. Таким же образом лимфатическая ткань отслаивается медиально и латерально от вены до визуализации поясничных вен. Поясничные вены пересекаются в месте впадения в нижнюю полую вену. Это позволяет отвести полую вену кпереди. Становится видна цепочка симпатических ганглиев и эфферентных симпатических волокон. Последние мобилизуются от лимфатической ткани и берутся на держалки. Эти волокна проходят в аорто-кавальном промежутке, затем пересекают правую подвздошную артерию, далее идут в малый таз. Далее диссекция продолжается на аорте. Диссекция, которая прежде была остановлена на уровне нижней брыжеечной артерии, продолжается вдоль дистальной аорты и правой подвздошной артерии до бифуркации правой подвздошной артерии. Ткань "скидывается" медиально в аорто-кавальный промежуток и правосторонние поясничные артерии пересекаются между шелковыми лигатурами. Сверху правая почечная артерия мобилизуется, с нее удаляется вся лимфатическая ткань по ходу артерии над ножкой диафрагмы. И, наконец, правый мочеточник мобилизуется латерально от правой паракавальной лимфатической клетчатки. К этому этапу сосуды и эфферентные симпатические волокна уже отделены и изолированы от лимфатической ткани. Лимфатическая ткань далее мобилизуется от задней брюшной стенки, используются клипсы, лигатуры или коагуляция по необходимости. В результате получаются два препарата: правый паракавальный и аорто-кавальный. Т.о., на гистологическое исследование отправляются три препарата. Задняя брюшина ушивается непрерывным рассасывающимся швом. Лапаротомный разрез закрывается с помощью непрерывного рассасывающегося шва. Пациент отправляется в палату, назогастральный зонд не используется.
Левосторонняя диссекция. Операционный доступ - срединная лапаротомия с использованием ранорасширителя. Левая нисходящая ободочная кишка сдвигается медиально после рассечения заднего листка брюшины. Обнажается заднее забрюшинное пространство. При отсутствии увеличенных лимфоузлов идентифицируются левые эфферентные симпатические волокна. Они мобилизуются от лимфатической ткани, берутся на держалки и мобилизуются проксимальнее по ходу вдоль левой боковой стенки аорты. Лимфатическая ткань над левой почечной веной рассекается и сдвигается вниз. Левая яичковая вена пересекается в месте впадения в левую почечную вену. Далее левая яичковая вена мобилизуется дистально до внутреннего пахового кольца. Семявыносящий проток пересекается между лигатурами, и культя семенного канатика удаляется. Хирургические препараты отправляются на гистологическое исследование. Разрез лимфатической ткани на 12 часах над аортой продолжается дистальнее от уровня пересечения левой почечной вены до бифуркации левых подвздошных сосудов. Лимфатическая ткань сдвигается латерально от аорты, при этом уделяется особое внимание тому, чтобы не повредить эфферентные симпатические волокна, которые были ранее мобилизованы. Далее мобилизуются и пересекаются левые поясничные артерии. Артерии должны пересекаться как можно ближе к аорте, чтобы избежать повреждения эфферентных симпатических волокон и симпатической цепочки. Выделяется левая почечная вена. В 40% случаев в нее впадает поясничная вена сзади, идущая от задней брюшной стенки. Последняя пересекается между двумя лигатурами. Выделяется левая почечная артерия и с нее удаляется лимфатическая ткань. Далее левый мочеточник мобилизуется и отводится латерально от лимфатической ткани. Таким образом, к этому моменту с аорты удалена вся лимфатическая ткань, эфферентные симпатические волокна выделены, и с них также удалена лимфатическая ткань; выделены также ворота почки и освобождены от лимфатической ткани. На последнем этапе удаляется лимфатическая ткань с задней брюшной стенки, при этом используются клипсы, коагуляция для контроля за гемостазом. Особенное внимание уделяется сохранению эфферентных симпатических волокон, которые могут переплетаться с лимфатической тканью. Чтобы предотвратить лимфорею, на лимфатическую ткань на ножке диафрагмы накладываются клипсы. Левая нисходящая ободочная кишка возвращается на свое анатомическое положение, и рана ушивается непрерывным швом. Больной отправляется в палату, назогастральный зонд не используется.
Результаты
Многие исследователи во всем мире продемонстрировали, что вышеописанные операции имеют терапевтической значение [6,7,8,9]. У пациентов с I стадией заболевания риск прогрессирования заболевания составляет не более 10%. Прогрессирование заболевание происходит за счет повышения маркеров или развития метастазов в легких, что позволяет избежать выполнения КТ органов брюшной полости после операции. При наличии II стадии заболевания выполнение ЗЛАЭ приводит к излечению у 50-75% больных в зависимости от объема поражения забрюшинных лимфоузлов. Таким пациентам периодически должно проводиться исследование органов грудной клетки с одновременным определением уровня маркеров АФП и ХГ. Как альтернатива, таким больным может быть проведено 2 курса химиотерапии по схеме ВЕР, хотя выживаемость пациентов со II стадией не изменяется в зависимости от того, проведена или нет им адъювантная химиотерапия [10]. Все исследования, в том числе и по данным Университета Индианы, подтвердили, что после выполнения ЗЛАЭ у больных I-II стадиями 5-летняя выживаемость составляет 99%.
Заключение
Техника нервосохраняющей ЗЛАЭ при клинически I стадии несеминомной опухоли яичка проста. Она состоит из строго определенных последовательных шагов, которые должны быть внимательно выполнены. Существуют и другие методы лечения данной группы пациентов, поэтому медицинский центр, обеспечивающий помощь больным раком яичка, должен владеть всеми возможными методами лечения несеминомы яичка I стадии. Нервосохраняющие ЗЛАЭ остаются эффективным и безопасным методом лечения больных с I стадией несеминомы.
Иллюстрации
 |
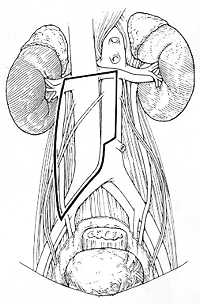 |
| Рис.1а | Рис.1б |
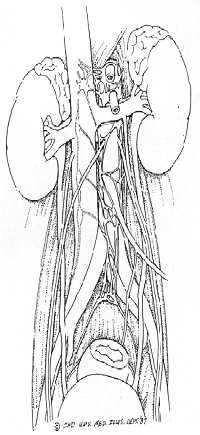 | |
| Рис.2 |
Список литературы.
1. Read G, Johnson RJ, Wilkinson PM, and Eddleston B: Prospective study of follow up alone in stage I teratoma of the testis. Brit Med J 287:1503, 1983.
2. Donohue JP, Zachary JM, and Maynard SD: Distribution of nodal metastases in nonseminomatous tstis cancer. J Urol 128:315, 1982.
3. Turek P, Lowther DN, and Carroll PR: Fertility issues and their management in men with testis cancer. UCNA 25:517, 1998.
4. Lampe H, Horwick A, Norman A, et al: Fertility after chemotherapy for testicular germ cell cancers. J Clin Oncol 15:239, 1997.
5. Baniel J, Foster RS, Rowland RG, et al: Complications of primary retroperitoneal lymph node dissection. J Urol 152:424, 1994.
6. Donohue JP, Thornhill JA, Foster RS, et al: Primary retroperitoneal lymph node dissection in clinical stage A nonseminomatous germ cell testis cancer: A review of the Indiana University experience (1965-1989). Brit J Urol 71:326, 1993.
7. Richie JP and Kantoff PW: Is adjuvant chemotherapy necessary for patients with stage B1 testicular cancer? J Clin Oncol 9:1393, 1991.
8. Pizzocaro G, Salvioni R, and Zanon F: Unilateral lymphadenectomy in intraoperative stage I nonseminomatous germinal testis cancer. J Urol 134:485, 1995.
9. Weissbach L, Boedefeld EA, and Horstmann DB: Surgical treatment of stage I nonseminomatous germ cell testis tumor. Eur Urol 17:97, 1990.
10. Williams SD, Stablein DM, Einhorn LH, et al: Immediate adjuvant chemothereapy versus observation with treatment at relapse in pathological stage II testicular cancer. New Engl J Med 317:1433, 1987.