Т.В. Наседкина
Институт молекулярной биологии им. В.А. Энгельгардта РАН, Москва
Возникновение онкологических заболеваний всегда связано с перестройками генетического аппарата клетки. С развитием методов молекулярно-генетического анализа было показано, что в большинстве случаев опухолевая трансформация клеток происходит в результате комплекса мутаций, к которым могут относиться изменения числа хромосом, качественные изменения самих хромосом (транслокации, делеции, инверсии), а также изменения на генном уровне (точечные мутации). Анализ этих мутаций, а также последующих изменений в транскрипционной программе клетки составляет основу молекулярной диагностики онкологических заболеваний, которая является как областью для научных исследований, так и имеет принципиальное значение для клиники. В молекулярной диагностике рака можно выделить следующие основные направления:
В настоящей работе представлены данные по определению хромосомных перестроек при лейкозах и анализу точечных мутаций в некоторых генах, вовлеченных в онкогенез или связанных с метаболизмом противораковых препаратов, с использованием технологии гелевых микрочипов, разработанной в Институте молекулярной биологии им. В.А. Энгельгардта РАН.
Гелевые микрочипы изготавливали методом фотоиндуцируемой совместной полимеризации олигонуклеотидных зондов и компонентов геля. Готовый микрочип представлял собой микроматрицу из иммобилизованных на стекле или пластике полусфер полиакриламидного геля диаметром около 100 мкм, содержащих олигонуклеотиды, химически пришитые к гелю. При проведении анализа на микрочипе использовали аллель-специфичную гибридизацию, при этом ДНК-мишень метили цианиновым красителем Cy5 в ходе мультиплексной полимеразной цепной реакции (ПЦР). Флуоресцентный сигнал с ячеек микрочипа регистрировали, используя портативный анализатор биочипов, снабженный камерой ПЗС и программным обеспечением. Проводилась визуальная оценка гибридизационной картины, а также компьютерный анализ изображения и выбор наиболее ярких элементов микрочипа с наибольшим значением нормированного сигнала.
Анализ хромосомных перестроек при лейкозах. Микрочип для идентификации транслокаций при лейкозах содержал около 50 типов иммобилизованных олигонуклеотидов, представляющих собой участки последовательностей генов, вовлеченных в транслокации. Нами были разработаны микрочипы, способные анализировать до 12 типов транслокаций и около 20 вариантов слияния между генами. Метод анализа клинического образца представлял собой комбинированное использование мультиплексной обратной транскрипции-полимеразной цепной реакции (ОТ-ПЦР) и гибридизации на микрочипе. Чувствительность метода такова, что возможно обнаружение одной клетки с хромосомной перестройкой на 10³ нормальных клеток, т. е. достаточна для выявления так называемой минимальной остаточной болезни. В целом, надежность выявления перестроек сравнима с ОТ-ПЦР и существенно превышает надежность цитогенетических методов. С помощью разработанного микрочипа был проведен анализ образцов костного мозга 600 детей с острыми лейкозами. Полученные данные позволили определить частоту встречаемости различных транслокаций среди российских пациентов, а также оценить клиническое значение различных транслокаций. Работа выполнена совместно с Е.А. Исаевой, В.С. Жариновым, А.И. Карачунским (НИИ детской гематологии МЗ и СР РФ) и Н.А. Гусевой (Институт молекулярной биологии им. В.А. Энгельгардта РАН).
Анализ полиморфизма в генах системы биотрансформации и фармакогенетика. Анализ полиморфных участков генов с помощью технологии биочипов дает важную информацию о способности организма пациента метаболизировать те или иные химиотерапевтические препараты. Эта информация может быть использована для индивидуализации терапии и корректировки дозы лекарства для того, чтобы снизить его токсическое воздействие при лечении.
Тиопурин S-метилтрансфераза (ТПМТ) – цитоплазматический фермент, который катализирует S-метилирование ароматических и гетероциклических сульфгидрильных соединений, включающих производные тиопурина. Производные тиопурина (азатиоприн, 6-меркаптопурин и тиогуанин) широко используются как иммуносупрессорные и противоопухолевые агенты при трансплантации органов, для лечения лейкозов, аутоиммунных и хронических воспалительных заболеваний. Наследственная недостаточность ТПМТ определяет непереносимость тиопуринов, в этом случае стандартные дозы этих лекарственных препаратов могут оказаться высокотоксичны и привести к летальному исходу. В настоящее время описаны около 20 различных аллелей, кодирующих фермент с низким уровнем активности. Подобно мутантным аллелям других полиморфных ферментов, данные аллели содержат точечные мутации, приводящие к аминокислотным заменам (ТПМТ*2, *3А, *3В, *3С, *3D, *5, *6, *7, *8), к преждевременному формированию терминирующего кодона (ТПМТ*3D) или разрушению участка сплайсинга (ТПМТ*4). Было проведено определение ТПМТ-генотипа у 280 пациентов с гемобластозами. Частота встречаемости и распределение мутантных аллелей гена ТПМТ в российской популяции пациентов с гемобластозами не отличались от таковой в популяции людей белой расы США и Европы (Caucasians). Так, самым частым мутантным аллелем был ТПМТ*3А (85,7%), более редкими аллелями ТПМТ*3С (9,5%) и ТПМТ*2 (4,8%). Ретроспективно была оценена также переносимость терапии 6-МП в зависимости от ТПМТ-генотипа и показано, что почти у 10% детей-пациентов с ОЛЛ в России имеется повышенный риск тиопуриновой токсичности вследствие наследственного дефицита ТПМТ. Работа выполнена совместно с Е.В. Самочатовой (НИИ детской гематологии МЗ и СР РФ), О.Е. Федоровой и Ж.М. Кожекбаевой (Институт молекулярной биологии им. В.А. Энгельгардта РАН) в рамках программы-поддержки госпиталя Сент-Джуд, Мемфис, США).
В настоящее время активно исследуется полиморфизм генов системы биотрансформации, в особенности генов семейства цитохромов Р450. Для многих из них выявлена ассоциация полиморфных вариантов с повышенным риском возникновения онкологических заболеваний, в частности, с риском развития гемобластозов. Был разработан биологический микрочип, который позволяет анализировать 18 мутаций в восьми генах системы биотрансформации: CYP1A1, CYP2D6, GSTT1, GSTM1, MTHFR, MTRR, NQO1, CYP2C9, CYP2C19 и NAT2. С помощью аллель-специфичной гибридизации на микрочипе протестированы 76 больных неходжкинскими лимфомами (НХЛ), 83 больных В-клеточным хроническим лимфоцитарный лейкозом (В-ХЛЛ) и 177 здоровых доноров. У больных В-ХЛЛ обнаружено статистически достоверное увеличение частоты встречаемости гетерозиготных и гомозиготных вариантов гена CYP1A1 по сравнению с группой здоровых доноров: сочетание полиморфных вариантов 4889A>G и 6235T>C (OR=1.745, 95% CI=1.076-2.829) и сочетание полиморфных вариантов 4887С>А, 4889A>G и 6235T>C (OR=1.687, 95% CI=1.097-2.596). У больных НХЛ выявлено статистически достоверное увеличение частоты встречаемости «нулевого» GSTM1 генотипа по сравнению с группой здоровых доноров (OR=1.817, 95% CI=1.052-3.140). Анализ ген-генных взаимодействий у больных В-ХЛЛ позволил выявить статистически достоверное увеличение частоты встречаемости “неблагоприятных” полиморфных вариантов гена CYP1A1 и «нулевого» GSTM1 генотипа: для сочетания «нулевого» GSTM1 генотипа с гетерозиготными и гомозиготными вариантами 6235T>C (OR=2.424, 95% CI=1.167-5.036); с комбинацией полиморфных вариантов 4889A>G и 6235T>C (OR=2.237, 95% CI=1.248-4.009) и с комбинацией полиморфных вариантов 4887С>А, 4889A>G и 6235T>C (OR=2.201, 95% CI=1.290-3.757). Таким образом, показано, что изученные полиморфные аллели генов CYP1A1 и GSTM1 и CYP2C9 значительно чаще встречаются у больных Т-клеточными лимфомами и В-ХЛЛ, чем у здоровых доноров. Разработанный микрочип является удобным методом анализа полиморфизма генов системы биотрансформации и может быть использован при изучении генетической предрасположенности к онкологическим заболеваниям и формировании групп риска. Работа выполнена совместно с Е.А. Никитиным и А.Б. Судариковым (Гематологический научный центр РАМН) и О.А. Гра, А.С. Глотовым (Институт молекулярной биологии им. В.А. Энгельгардта РАН).
Анализ мутаций в генах BRCA1, BRCA2 и СHEK2 при раке молочной железы и раке яичников. Рак молочной железы (РМЖ) занимает первое место по частоте злокачественных заболеваний у женщин. В структуре всех онкологических заболеваний в российской популяции на долю РМЖ приходится более 15%. Частота рака яичников (РЯ) составляет около 5%, однако этот вид рака диагностируется на поздних стадиях и характеризуется низкой выживаемостью, являясь одной из лидирующих причин смертности женщин в индустриальных странах. Наряду с ростом заболеваемости злокачественными опухолями молочной железы и женских половых органов, растет число пеpвично-множественных синхpонных и метахронных злокачественных новообразований (ПМЗН) указанных локализаций. Установлено, что у женщин с ПМЗН наиболее часто поражаются молочные железы, тело матки, яичники и шейка матки. Вторая первичная опухоль часто локализуется также в щитовидной железе, толстой кишке и желудке.
Одним из значительных достижений в молекулярно-генетических исследованиях РМЖ и РЯ явилось открытие генов BRCA1 и BRCA2, герминальные мутации которых определяют наследственную форму этих новообразований. Наследственные мутации генов BRCA1 и BRCA2 обусловливают от 56 до 80% риска развития РМЖ на протяжении всей жизни (в возрасте до 70 лет), а также от 10 до 30% риска развития РЯ, рака желудка и рака толстой кишки. Герминальная мутация 1100delC в 10 экзоне гена CHEK2 впервые была найдена в семьях с синдромом Ли-Фраумени. В нескольких исследованиях показано, что этот вариант ассоциирован с предрасположенностью к РМЖ у женщин и раку предстательной железы у мужчин. Поскольку идентификация мутаций в этих генах является на сегодняшний момент одной из наиболее важных проблем генодиагностики, актуальным становиться создание точного и быстрого метода определения мутаций, позволяющего проводить скрининговое обследование в различных группах населения.
Цель работы состояла в создании микрочипа для анализа наиболее распространенных в популяциях Восточной Европы и России мутаций в генах BRCA1/2 и CHEK2 Разработанный подход, сочетающий мультиплексную ПЦР и аллель-специфичную гибридизацию на микрочипе, был использован для тестирования больных с РМЖ, РЯ и ПМЗН с поражением яичников на наличие герминальных мутаций в указанных генах.
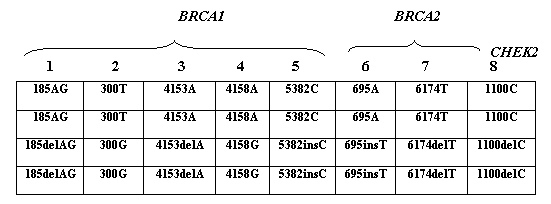
Олигонуклеотидные пробы, расположенные в ячейках микрочипа, представляли собой участки генов BRCA1, BRCA2 и CHEK2, выбранные таким образом, чтобы вариабельный нуклеотид находился в центральном положении. Каждая проба на микрочипе была продублирована. Олигонуклеотиды в двух верхних строках соответствовали последовательности дикого типа, в двух нижних строках - мутантным последовательностям (рис. 1). На рис. 2 представлены примеры гибридизационных картин.
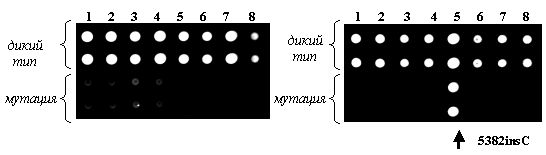
Разработанный протокол был использован для тестирования 411 анонимных образцов ДНК от пациентов с диагнозом органоспецифический РМЖ, 68 анонимных образцов ДНК от пациентов с диагнозом органоспецифический РЯ и 19 образцов ДНК от пациентов, имеющих ПМЗН с поражением яичников на наличие мутаций в BRCA1/2 и СHEK2 генах. Результаты тестирования пациентов с РМЖ представлены в табл. 1.
Таблица 1.
Результаты обследования пациентов с диагнозом РМЖ на наличие мутаций в генах BRCA1/2 и СHEK2.
| Ген | Мутация | n | % |
|---|---|---|---|
| BRCA1 | 185delAG | 2 | 0.49 |
| BRCA1 | 300T>G | 3 | 0.73 |
| BRCA1 | 4153delA | 3 | 0.73 |
| BRCA1 | 5382insC | 16 | 3.9 |
| BRCA2 | 695insT | 1 | 0.24 |
| BRCA2 | 6174delT | 1 | 0.24 |
| CHEK2 | 1100delC | 7 | 1.71 |
| Пациенты с мутациями (всего) | 33 | 8% | |
| Общее количество человек | 411 | ||
Идентификация мутаций важна как для заболевших РМЖ/РЯ пациентов, так и для родственников пациентов, у которых еще не возникли или не диагностированы опухоли. Разработка комплекса профилактических мероприятий (регулярная диспансеризация, соблюдение здорового образа жизни, хирургические профилактические методы) для так называемых здоровых носителей мутации, позволит в дальнейшем предотвратить возникновения заболевания или выявить его на более ранних стадиях.
Таблица 2.
Результаты обследования пациентов с диагнозом РЯ и ПМЗН на наличие мутаций в генах BRCA1/2 и СHEK2.
| Ген | Мутация | Диагноз | |||
|---|---|---|---|---|---|
| Органоспецифический РЯ | ПМЗН с поражением яичников | ||||
| число | % | число | % | ||
| ВRСА1 | 185delAG | 1 | 1.47 | 1 | 5.26 |
| ВRСА1 | 300T>G | 0 | 0 | 3 | 15.79 |
| ВRСА1 | 4153delA | 0 | 0 | 1 | 5.26 |
| ВRСА1 | 5382insC | 6 | 8.82 | 5 | 26.32 |
| Пациенты с мутациями (всего) | 7 | 10.29 | 10 | 52.63 | |
| Общее количество человек | 68 | 19 | |||
Работа выполнена совместно с Л.Н. Любченко, Ю.Г. Паяниди, Т.П. Казубской, Р.Ф. Гарькавцевой (ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России), Ф.А. Амосенко (Медико-генетический научный центр РАМН) и О.Е. Федоровой (Институт молекулярной биологии им. В.А. Энгельгардта РАН).
Заключение. Развитие технологии микрочипов существенно расширило область молекулярно-генетических исследований в онкологии. В практическом отношении с помощью микрочипов уже сегодня можно решать следующие задачи:
Исследования получили финансовую поддержку Российского фонда фундаментальных исследований (грант № 06-04-49771).