БИСФОСФОНАТЫ В СИСТЕМЕ ПАЛЛИАТИВНОГО ЛЕЧЕНИЯ КОСТНЫХ МЕТАСТАЗОВ
Орлова Р.В., Н.В. Тюкавина
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Костная ткань является разновидностью соединительной ткани, которая вместе с хрящевой образует скелетную систему и характеризуется динамичностью и постоянной перестройкой, не являясь «мертвой», как было принято считать раньше. На протяжении всей жизни скелет подвергается ремоделированию. Этот процесс представляет собой упорядоченный цикл событий, в котором фаза костной резорбции предшествует фазе костеобразования, и подразумевает наличие дискретных клеточных и метаболических явлений в пространстве и, следовательно, во времени (Frost, 1973; Parfitt, 1983). Коротко рассмотрим основные механизмы.
Злокачественные опухоли нередко сопровождаются поражением костей. В основе патогенеза костной резорбции при опухолях лежит нарушение нормального костеобразования. Опухолевые клетки продуцируют вещества, стимулирующие как остеокласты, так и остеобласты, основным из которых является PTHrP (белок, ассоциированный с паратиреоидным гормоном). Этот белок способен прямо или косвенно стимулировать остеокласты к деградации кости и высвобождению факторов роста, включая ИЛ-6, трансформирующий фактор роста
Чаше всего в кости метастазируют раки молочной железы (Lipton A., 2003) и простаты (Eaton C.L., 2003), что может отражать как высокую частоту этой патологии, так и длительность течения этих заболеваний (Yoneda T., 1995). Вероятно, существуют и другие причины такой предрасположенности опухолей определенной локализации к метастазированию в кости (Mundy G.R., 2002). Из других опухолей, часто метастазирующих в кости, следует отметить рак почки (Jung S.T. с соавт., 2003), рак щитовидной железы, рак легкого и множественную миелому.
Таблица 1.
Оценка прогностической значимости костных метастазов при некоторых опухолях.
| Локализация опухоли | Частота встречаемости костных метастазов | 5-летняя выживае- мость |
Медиана выживае- мости |
|---|---|---|---|
| Множественная миелома | 95-100% | 10-30% | 20-36 мес. |
| Рак молочной железы | 65-75% | 20% | 24 мес. |
| Рак предстательной железы | 65-75% | 25% | 40 мес. |
| Рак легкого | 30-40% | <2-5% | <6 мес. |
В табл. 1 представлены сводные данные некоторых исследователей (Mundy, 1997; Coleman, 1997; Ginsberg с соавт., 2001), касающиеся прогностической значимости костных метастазов при некоторых опухолях.
Основные клинические проявления костных метастазов характеризуются тетрадой симптомов: боль, патологические переломы, компрессия спинного мозга и гиперкальциемия, что в значительной степени определяет тяжесть состояния больного, а в ряде случаев является причиной смерти. Раннее выявление и лечение метастазов в костях обеспечивает максимальное повышение качества жизни пациента и его функциональную активность.
Современный подход к противоопухолевому лечению метастазов в костях отличается мультидисциплинарностью, которая включает в себя системную противоопухолевую терапию (химиотерапию, гормональную терапию), облучение и паллиативные хирургические методы лечения (Mohla S. с соавт., 2003).
Однако установление основных этапов патогенеза костных метастазов послужило основанием для создания препаратов, обладающих способностью оказывать влияние не столько на метаболизм самой опухоли, сколько на костный обмен, нарушенный опухолевым процессом (Beghe, Luzzani, 1993). Подобными свойствами обладают бисфосфонаты. Они явились первыми специфическими средствами для лечения метастазов в кости, представляя собой стабильные аналоги природных неорганических фосфатов.
Механизм их действия сложен и до конца не ясен. С одной стороны, бисфосфонаты проникают в костную ткань, концентрируются вокруг остеокластов, создавая при этом высокую концентрацию в лакунах резорбции, захватываются остеокластами, где они нарушают формирование цитоскелета, необходимого для прикрепления остеокласта к костной ткани со снижением секреции лизосомальных ферментов (Sato с соавт., 1991; Zimolo с соавт., 1995; Fleisch, 1997; Rogers с соавт., 1997).
Другой эффект бисфосфонатов заключается в апоптозе остеокластов, что подтверждается появлением особых изменений в клетке и структуре ядра (Hughes с соавт., 1995). Одновременно отмечается потеря клетками-предшественниками остеокластов способности дифференцировки и созревания, что приводит к уменьшению числа остеокластов. Кроме того, бисфосфонаты действуют на остеобласты и макрофаги в зоне костной резорбции, ингибируя синтез остеокласт-стимулирующих факторов (Shipman с соавт., 1997).
Как показали последние исследования, бисфосфонаты не только снижают потерю костной ткани, но и уменьшают объем опухолевых масс (Clark с соавт., 1991; Diel с соавт., 1997; Vinholes с соавт., 1997). Вероятно, это происходит за счет блокирования функции остеокластов, что ведет к разрыву порочного круга и прекращению подпитки опухолевых клеток факторами роста и цитокинами, вырабатываемыми костной тканью. Но это может также быть результатом прямого действия бисфосфонатов (или возможно токсических продуктов остеокластов) на опухолевые клетки (Mundy, 1999). Поднимался в литературе и вопрос о возможном влиянии бисфосфонатов на висцеральные метастазы, но подтверждения этому получено не было (Michigami T. с соавт., 2002).
Все бисфосфонаты являются производными пирофосфата, однако в отличие от него, характеризуются наличием Р-С-Р структуры (рис. 1), которая обеспечивает их активность и связывание с костным матриксом, а также боковой цепи, определяющей их антирезорбционную активность, побочные эффекты и механизм действия (Fleish, 1995).
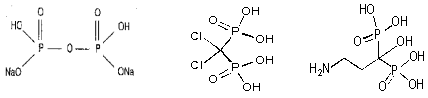 |
||
| пирофосфат | клодронат | памидронат |
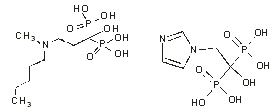 |
|
| ибандронат | золедронат |
Рис 1. Структурные формулы пирофосфата и бисфосфонатов (клодронат, памидронат, ибандронат, золедронат).
В настоящее время существует три поколения бисфосфонатов. В табл. 2 представлены эти группы со сравнительной характеристикой их активности.
Таблица 2.
Антирезорбционная активность различных бисфосфонатов (in vitro).
| Препараты | Антирезорбционная активность |
|---|---|
| Первое поколение:
клодронат тилудронат |
1 10 10 |
| Второе поколение:
алендронат |
100 1 000 |
| Третье поколение:
золедронат |
10 000 20 000 |
Антирезорбционная активность бисфосфонатов, указанная в табл. 2, определялась in vitro. Однако в клинических исследованиях эти данные не подтверждаются. Так Diel с соавт. представили результаты рандомизированного исследования трех групп больных с метастатическим поражением скелета при раке молочной железы. Пациенты первой группы получали 60 мг памидроната, второй группы – 900 мг клодроната в/в каждые 3 недели, третьей группы – клодронат 2400 мг в сутки, внутрь. Курс лечения составил 18 мес. Снижение болевого синдрома в костях наблюдалось у 30% больных в I группе; у 25% во второй и у 15% в третьей. Вертебральные переломы наблюдались у 13%, 12% и 20% пациентов соответственно. Таким образом, в клинических исследованиях отмечены различия в эффективности некоторых бисфосфонатов, но они не так существенны, как при исследованиях in vitro.
Бисфосфонаты не являются альтернативой противоопухолевому лечению и применяются независимо от него. Однако, по сравнению с другими препаратами, оказывающими влияние на костную резорбцию, они обладают рядом преимуществ (высокая эффективность, низкая токсичность, наличие пероральной формы). Это делает их препаратами выбора при наличии костных метастазов (Taube с соавт., 1993; Kanis с соавт., 1994), так как бисфосфонаты, обладая уникальной способностью ингибировать костную резорбцию при метастазах солидных опухолей, оказывают лечебное и профилактическое действие при гиперкальциемии, болевом синдроме, существенно снижают риск развития патологических деформаций и переломов. Таким образом, несмотря на различную антирезорбционную активность in vitro, использование любого из представителей группы бисфосфонатов при костных метастазах обеспечивает снижение риска патологических переломов, уменьшение выраженности болевого синдрома, нормализацию уровня кальция крови.
В табл. 3 представлены рандомизированные исследования по изучению наиболее широко используемых бисфосфонатов с точки зрения их влияния на основные клинические симптомы костных метастазов при разных солидных опухолях.
Таблица 3.
Эффективность бисфосфонатов у больных солидными опухолями c метастазами в костях (плацебо-контролируемые исследования).
| Автор | Препарат | Локализация опухоли | Колич. больных (препарат/ плацебо) |
Выводы |
|---|---|---|---|---|
| McCloskey, 1998 | Клодронат 1600 мг/день внутрь |
Множествен- ная миелома |
536 (264/272) | Снижение частоты невертебральных переломов на 50% (6,8%/13,2%), вертебральных переломов на 17% (38%/55%), других патологических переломов на 23% (45%/68%), тяжелой гиперкальциемии на 50% (5,1%/10,1%) |
| Vorreuther, 1992 | Клодронат 300 мг в/в 8 дней→ 1600 мг внутрь ежедневно |
Рак предстательной железы (гормоно-резистентный) | 60 (35/25) | Снижение болевого синдрома у 71% пациентов, полное исчезновение болевого синдрома у 26% больных |
| Kanis, 1996 | Клодронат 1600 мг/день внутрь |
Рак молочной железы | 133 (66/67) | Снижение числа скелетных метастазов на 50% (32/63), числа пациентов с развившимися костными метастазами на 26% (15/19), числа вертебральных переломов на 29% (35/54), невертебральных переломов на 75% (2/8) |
| Conte, 1996 | Памидронат 45 мг в/в каждые 3-4 нед. |
Рак молочной железы | 295 | Увеличение времени до прогрессирования костных метастазов на 48% |
| Hortobagy, 1996 | Памидронат 90 мг в/в каждые 4 нед. |
Рак молочной железы | 382 (185/197) | Увеличение времени до первого клинического симптома на 47%. Непозвоночные переломы развились у 23% пациентов в группе памидроната и у 38% пациентов в группе плацебо, гиперкальциемия – у 7% и 15% пациентов, потребность в лучевой терапии – 28% и 45% соответственно. |
| Jean-Jacques Body | Бондронат 2 мг, 6 мг в/в |
Рак молочной железы | 462 | Снижение числа новых костных осложнений на одного пациента за год с 1,29 в группе плацебо до 0,93 в группе пациентов, получавших бондронат 6 мг (р<0,05). Снижение числа костных осложнений на одного пациента в течение года снизилось с 2,18 в группе плацебо до 1,83 в группе больных, получавших 2 мг бондроната, и до 1,61 в группе больных, получавших 6 мг бондроната (р<0,05). Выявлено достоверное снижение выраженности боли у пациентов, получавших 6 мг бондроната |
| Rosen, 2001, 2002 | Золедронат 4 мг в/в 15 мин. каждые 3 недели |
Рак легкого и другие cолидные опухоли | 507 (257/250) | Снижение числа пациентов с возникшими костными осложнениями (38% против 47%, р=0,047), частоты регистрации костных осложнений (1,82 против 2,88 осложнения в год; р=0,049). Медиана времени до возникновения первого костного осложнения при использовании золедроната 4 мг увеличилась более чем на 2 мес. |
Бисфосфонаты хорошо переносятся большинством пациентов. Самыми частыми нежелательными явлениями являются гриппоподобные симптомы (лихорадка, артралгии, миалгии и боли в костях), повышенная утомляемость, желудочно-кишечные реакции, слабость, одышка и отеки. Эти симптомы обычно слабо выражены, быстро купируются и не требуют медикаментозного лечения.
Следует соблюдать осторожность при одновременном применении бисфосфонатов и аминогликозидов, поскольку оба препарата могут оказывать аддитивное влияние на концентрацию кальция в сыворотке крови, в результате чего уровень кальция в сыворотке может оставаться сниженным более длительно, чем это требуется.
Бисфосфонаты практически не метаболизируются в организме: 40-50% введенного препарата экскретируется с мочой в течение 48 ч. Остаток абсорбируется костной тканью и в последующем медленно элиминируется почками.
Рассмотрим подробнее основных представителей бисфосфонатов, наиболее часто используемых в повседневной практике.
Представителем первой генерации является клодронат (Бонефос) (рис. 1). Препарат зарегистрирован в Российской Федерации 20.07.1993 г., производится в виде пероральной (в капсулах) и внутривенной (ампулах) лекарственных формах. Следует отметить, что это единственный препарат для пероральной терапии, который в настоящее время зарегистрирован в России. Недостатком является плохая абсорбция из желудочно-кишечного тракта. Не более 1-5% от введенной пероральной дозы клодроната попадает в кровяное русло. Основная проблема – это взаимодействие с препаратами или продуктами с высоким содержанием кальция (антациды) или другими двухвалентными ионами металлов. Эти вещества, связываясь с клодронатом в желудочно-кишечном тракте, значительно снижают его эффективность, в ряде случаев даже нейтрализуя его. Поэтому при назначении пероральной формы следует рекомендовать прием клодроната за 1 ч до приема пищи, напитков или любых других препаратов. Часто сообщается о желудочно-кишечных осложнениях (дискомфорт, боли в области желудка, диарея, запоры) при приеме препарата внутрь в дозе 1600 мг в сутки. Однако в контролируемых исследованиях частота этих побочных эффектов оказалась такой же, как и в группе больных плацебо (Lahtinen с соавт., 1992).
Клодронат назначают в дозах от 300 до 1500 мг/сут. в течение 1-10 дней. Этот бисфосфонат был изучен в плацебо-контролируемом исследовании для оценки эффективности в отношении индуцированной опухолью гиперкальциемии: назначение клодроната привело к снижению уровня кальция в крови у 17 из 21 больного, в то время как в группе плацебо это удалось сделать только у 4 из 19 (Rostein с соавт., 1992). Повторяющиеся ежедневные инфузии 300 мг переносятся хорошо и позволяют добиться нормализации уровня кальция у 80-90% пациентов (Paterson с соавт., 1983; Bonjour с соавт., 1988). O’Rourke с соавт. (1993) показали, что однократная инфузия 1500 мг клодроната по своей эффективности не уступает инфузии этого же препарата в дозе 300 мг/сут. в течение 5 дней. Клодронат необходимо вводить медленно (в течение не менее 2-3 ч), так как быстрая инфузия сопровождается внутрисосудистым связыванием кальция, что сопряжено с образованием нефротоксических комплексов и может привести к развитию острой почечной недостаточности.
Памидронат (Аредиа) - представитель второго поколения бисфосфонатов, содержащий в своей молекуле один атом азота (рис. 1). Присутствие атома азота в боковой цепи объясняет уникальный механизм действия, связанный со способностью ингибировать процесс модификации белков в остеокластах, что приводит к их апоптозу (Luckman с соавт., 1998). Бисфосфонаты, не содержащие азот, такие как клодронат, являются менее мощными ингибиторами остеокласт-опосредованной костной резорбции, так как имеют несколько иной механизм действия. Памидронат является эффективным средством терапии больных множественной миеломой и раком молочной железы с метастазами в кости, т.е. опухолями, характеризующимися развитием, прежде всего, остеолитических метастазов.
Памидронат рекомендуется применять в дозе 60-90 мг внутривенно в виде 4-часовой инфузии с интервалом в 3 недели. Многочисленные исследования показали, что доза в 90 мг позволяет достичь нормокальциемии более чем у 90% пациентов. Несмотря на подтвержденный дозозависимый эффект памидроната, высокие дозы его практически не используются из-за побочных эффектов со стороны желудочно-кишечного тракта.
Эффективность лечения зависит от ряда факторов. Оказывается, что циркулирующий в крови PTHrP влияет на величину ответа бисфосфонатов, так как стимулирует почечную тубулярную реабсорбцию кальция. Вот почему больные с повышенным уровнем PTHrP отвечали на введение памидроната в меньшей степени, чем пациенты, у которых этот белок не был обнаружен (Coleman R.E. с соавт., 1997). Последние рандомизированные исследования показали некоторые преимущества памидроната перед клодронатом у больных с индуцированной опухолью гиперкальциемией, прежде всего в продолжительности нормокальциемии, так как средняя продолжительность эффекта клодроната составила 14 дней в сравнении с 28 днями для памидроната (Purohit с соавт., 1995). Показана возможность использования бисфосфонатов с целью предупреждения осложнений костного метастазирования. Результаты исследований с клодронатом и памидронатом выявили достоверное снижение частоты проявлений осложнений при пролонгированном применении памидроната и клодроната (табл. 3).
Бондронат (Ибандронат) является одним из представителей третьего поколения и относится к азотсодержащим бисфосфонатам (рис. 1). Применяется в дозе 2-4 мг в сутки в виде 15-минутных внутривенных инфузий 1 раз в 4 недели. В дозах, превышающих терапевтические, ибандронат, в отличие от памидроната, не вызывает нарушения минерализации костной ткани и не приводит к увеличению частоты побочных эффектов. Кроме того, препарат не обладает нефротоксичностью и не вызывает местных побочных эффектов в месте инфузии, что свойственно бисфосфонатам первого и второго поколений. Он показан для лечения гиперкальциемии у больных со злокачественными образованиями с повышенным уровнем PTHrP. При мета-анализе нескольких рандомизированных исследований было показано, что применение ибандроната вызвало статистически значимое снижение скелетных осложнений в среднем на 30% (Pavlis, Stokeler., 2002).
Золедронат (Зомета) – гетероциклический бисфосфонат третьего поколения, содержащий в имидазольном кольце боковой цепочки два атома азота, расположенных в противоположных позициях (рис. 1). Особенность молекулярного строения определяет более высокий потенциал золедроновой кислоты. В исследованиях in vitro и in vivo установлена способность препарата ингибировать рост клеток эндотелия, с чем связывают возможный антиангиогенный эффект (Boisser с соавт., 2000; Senaratue с соавт., 2000).
Рекомендуемая доза золедроната составляет 4 мг; эту дозу инфузируют в течение 15 мин. один раз в 3-4 недели. В период терапии пациентам следует назначать кальций (500 мг) и Витами D (400 МЕ). Кальций назначают для предотвращения транзиторной гипокальциемии и повышения уровня паратиреоидного гормона, являющегося следствием гипокальциемии.
Золедронат был зарегистрирован на основании результатов трех крупных клинических исследований III фазы у пациентов со следующими распространенными злокачественными новообразованиями: миеломная болезнь, рак молочной железы, рак предстательной железы, немелкоклеточный рак легкого и другие солидные опухоли. У больных раком молочной железы и у пациентов с миеломной болезнью эффективность золедроната и памидроната с точки зрения снижения частоты костных осложнений была сходной, но пациенты, которые получали золедронат, значимо реже нуждались в лучевой терапии костей. Кроме того, дополнительная 12-месячная фаза клинического исследования показала, что среди больных раком молочной железы риск развития костных осложнений был на 18% ниже при лечении золедронатом, чем при лечении памидронатом (Rosen с соавт., 2001, 2002).
У больных раком предстательной железы с костными метастазами золедронат значимо эффективнее, чем плацебо, снижал частоту костных осложнений, особенно патологических переломов. Кроме того, в группе, получавшей 4 мг золедроната, по сравнению с группой плацебо, была значимо ниже суммарная частота лучевой терапии на область метастазов в кости и хирургического вмешательства на кости, в том числе по поводу сдавления спинного мозга, а также необходимости изменения проводимой противоопухолевой терапии вследствие болей в костях. Это исследование стало первым рандомизированным клиническим исследованием, где бисфосфонат существенно снизил частоту костных осложнений у больных метастазирующим раком предстательной железы, который характеризуется остеобластными метастазами. Следует, отметить, что золедронат не влиял на такие показатели как прогрессирование костных метастазов, время до прогрессирования рака и выживаемость (Saad с соавт., 2002).
В заключение можно сказать, что бисфосфонаты являются эффективным и обязательным средством паллиативного лечения больных с костными метастазами, позволяющим значительно улучшить качество жизни этих больных.
Список литературы:
1. Модников О.П., Новиков Г.А., Родионов В.В. Костные метастазы рака молочной железы (патогенез. Клиника, диагностика и лечение) // Москва – 2001.
2. Моисеенко В.М., Семиглазов В.Ф., Тюляндин С.А. Современное лекарственное лечение местно-распространенного и метастатического рака молочной железы // «Грифон». – 1997.
3. Beghe F., Luzzani M. A new schedule for clodronate treatment in patient with breast cancer and bone metastases // Ann. NY Acad Science. 1993.`698: 367-431.
4. Boissier S, Ferrers M, Peyruchaud O. et al. Cancer Res 2000; 60: 2949—54.
5. Bonjour J.P., Philippe J., Guela G., et al. Bone and renal components in hypercalciemia of malignancy and responses to a single infusion of clodronate // Bone. – 1988. – V.9. – P. 123-130.
6. Boyce BF, Yoneda T, Guise TA. Factors regulating the growth of metastatic cancer in bone // Endocr Relat Cancer. 1999; 6: 333-347.
7. Clark N.V., Holbrook I.B., McClure J. et al. Osteoclast inhibition by pamidronate in metastatic prostate cancer: a preliminary study // Br. J. Cancer. – 1991. – V.63. - P. 420-423.
8. Coleman R.E., Purohit O.P., Vinholes J.J., Zekri J. High dose pamidronate: clinical and biochemical effects in metastatic bone disease // Cancer. – 1997. – V. 80 (Suppl.8). – P. 1686-1690.
9. Conte FF, Mauriac L, Calabresi F et al. Delay in progression of bone metastases treated with intravenous pamidronate: Results from a multicentre randomized controlled trial // J Clin Oncol 1996; 14; 2552-2559.
10. Conte PF, Latreille J, Mauriac L et al. Delay in progression of bone metastases in breast cancer patients treated with intravenous pamidronate: results from a multinational randomized controlled trial. The Aredia Multinational Cooperative Group // J Clin Oncol 1996; 14:2552-2559.
11. Diel I, Solomayer F.-F, Costa SI et al. Reduction in new metastases in breast cancer with adjuvant clodronate treatment // N Engl J Med 339: 357-363, 1998.
12. Eaton C.L., Coleman R.E. Pathophysiology of bone metastases from prostate cancer and the role of bisphosphonates in treatment // Cancer Treat Rev – 2003 – 29(3) – p. 189-98.
13. Fleisch H. Bisphosphonates in Bone Disease-From the laboratory to the Patient // New York: The Parthenon Publishing Group. – 1997.
14. Fleish H. Bisphosphonates – preclinical // In: Bisphosphonates in Bone Disease-From the laboratory to the Patient. 2d ed. Carnforth, England: Parthenon. – 1995. – P. 38-56.
15. Frost H.M. Bone remodeling and its relationship to metabolic bone disease // Springfield: Thomas. – 1973.
16. Ginsberg R.J., Vokes E.E., Rosenzweig K. // Non-small cell lung cancer. In: DeVita V.T., Jr Hellman S., Rosenberg S.A., eds. // Cancer: Principles and Practice of Oncology. Philadelphia: Lippincott Williams and Wilkins; 6th ed. 2001: 925-983.
17. Goltzman D. Mechanisms of the development of osteoblastic metastases // Cancer.1997; 80: 1581-1587.
18. Goltzman D., Stewart A.F., Broadus A.E. Malignancy-associated hypercalcemia: evaluation with a cytochemical bioassay for parathyroid hormone // J. Clin. Endocrinol. Metab. – 1981. – V. 53. – P. 899-904.
19. Hortobagyi GN, Theriault RL, Porter L, et al. Efficacy of pamidronate in reducing skeletal complications in patients with breast cancer and lytic bone metastases // New Engl J Med 335: 1785-1791, 1996.
20. Jung S.T., Ghert M.A., Harrelson J.M., Scully S.P. Treatment of osseous metastases in patients with renal cell carcinoma // Clin Orthop. – 2003 – (409) – p. 223-31.
21. Kanis J.A., O’Rourke N., McCloskey E.: Consequences of neoplasia induced resorption and the use of clodronate (Review) // Int J Oncol 5: 713-731, 1994.
22. Lahtinen R, Laakso M, Palva I et al. Randomized, placebo-controlled multicentre trial of clodronate in multiple myeloma // Lancet 340:1049-52, 1992.
23. Lipton A, Small E, Saad F, et al. The new bisphosphonate, ZOMETA® (zoledronic acid), decreases skeletal complications in both lytic and blastic lesions: a comparison to pamidronate. Presented at the Chemotherapy Foundation Symposium XIX. November 7–10, 2001. New York, NY. Abstract number 34.
24. Lipton A, Theriault 1, Leff R, et al. Long term reduction of skeletal complications in breast cancer patients with osteolytic bone metastases receiving hormone therapy, by monthly 90 mg pamidronate {Aredia™) infusions. ASCO Proceedings16: 152, 1997.
25. Lipton A. Bisphosphonates and metastatic breast carcinoma // Cancer – 2003 – 97(3 Suppl) – p. 848-53.
26. Lipton A. Bone metastases in breast cancer // Curr Treat Options Oncol. – 2003 – 4(2) – p. 151-8.
27. Michigami T., Hiraga T., Williams P.J., Niewolna M., Nishimura R., Mundy G.R., Yoneda T. The effect of the bisphosphonate ibandronate on breast cancer metastasis to visceral organs // Breast Cancer Res Treat. – 2002 – 75(3) – p. 249-58.
28. Mohla S., Weilbacher K.N., Cher M.L., Oyajobi B.O., Poznak C.V., Clohisy D.R. Third North American Symposium on Skeletal Complications of Malignancy: summary of the scientific sessions // Cancer – 2003 – 1 – 97(3 Suppl) – p. 719-25.
29. Mundy G.R. Mechanisms of bone metastasis // Cancer. – 1997. – V. 80(Suppl.8). – P.1546-1556.
30. Mundy G.R. Metastasis to bone: causes, consequences and therapeutic opportunities // Nat Rev Cancer – 2002 – 2(8) – p. 584-93.
31. Mundy G.R. Preclinical studies of metastasis: experimental models and novel techniques to detect micrometastases // Program and abstracts of 22nd San Antonio Brest Cancer Symposium; Desember 8-11, 1999; San Antonio, Texas.
32. Mundy GR. Bisphosphonates as cancer drugs // Hospital Practice. 1999; 34: 81-94.
33. O’Rourke N.P., McCloskey E.V., Vasikaran S. et al. Effective treatment of malignant hypercalcaemia with a single intravenous infusion of clodronate // Br. J. Cancer. – 1993. – V. 67. – P. 560-563.
34. Parfitt A.M. The physiologic and clinical significance of bone histomorphometric data // In: Bone histomorphometric techniques. Ed. Recker R. – Boca Raton: CRC Press. – 1983. – P. 143-223.
35. Purohit OP, Radstone CR, Anthony C, et al. A randomized double-blind comparison of intravenous pamidronate and clodronate in the hypercalcaemia of malignancy // Br J Cancer 72: 1289-1293, 1995.
36. Rogers MJ, Xiong X, Ji X et al. Inhibition of growth of Dictyostelium discoideum amoeboe by bisphosphonates is dependent on cellular uptake // Pharmacol Res. 14: 625-630, 1997.
37. Rosen LS, Gordon D, Kaminski M, et al. Zoledronic acid versus pamidronate in the treatment of skeletal metastases in patients with breast cancer or osteolytic lesions of multiple myeloma: A phase III, double-blind, comparative trial // Cancer J. 2001; 7: 377-387.
38. Rostein S., Glas U., Eriksson M., Pfeiffer P., Hansen J., et al: Intravenouse clodronate for the treatment of hypercalcemia in breast cancer patient with bone metastases – a prospective randomized placebo-controlled multicentre study // Eur J Cancer 28A: 890-893, 1992.
39. Saad F, Gleason D, Murray R, et al. Zometa is effective in the treatment of bone metastases from prostate cancer: Results of a large phase III, double-blind randomized trial. Presented at the SUO meeting Abstract 2002.
40. Sato M, Crasser W, Endo N et al. Bisphosphonate action: alendronate localization in rat bone and effects on osteoclast ultrastructure // J Clin Invest 1991:88:2095-2105.
41. Senaratue SG, Pirianov G, Mansi JL. et al // Br J Cancer 2000; 82: 1459-68.
42. Shipman CM, Rogers MJ, Apperiey JF et al. Bisphosphonates induce apoptosis in human myeloma cell lines: a novel anti-tumour activity // Br J Haematol 1997:98:665-672.
43. Taube T., Elomaa I., Blomqvist C., Beneton MNC, Kanis J.A: Comparative effects of clodronate and calcitonin in metastatic breast cancer // Eur J Oncol 29:1677-1681, 1993.
44. Vinholes JJ, Purohit OP, Abbey ME et al. Evaluation of new bone resorption markers in a randomized comparison of pamidronate or clodronate for hypercalcaemia of malignancy // J Clin Oncol 15: 131-138, 1997.
45. Vinholes JJ, Purohit OP, Abbey ME et al. Relationships between biochemical and symptomatic response in a double-blind randomized trial of pamidronate for metastatic bone disease // Ann Oncol 1997; 8: 1243-1250.
46. Yoneda T, Williams P, Dunstan С et al. Growth of metastatic cancer cells in bone is enhanced by bone derived insulin-like growth factors (IGFs) // J Bone Miner Res 1995; 10 (suppl 1):P 269.
47. Zimolo Z., Wesolowski G., Rodan G.A. Acid extrusion in produced by osteoclast attachment to bone. Inhibition by alendronate and calcitonin // J. Clin. Invest. – 1995. - V.96. – P.2277-2283.