ИНГИБИТОРЫ РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА (EGFR)
Д.А. Носов
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
В настоящее время огромное число фундаментальных исследований сфокусировано на поиске новых рациональных подходов к противоопухолевой терапии. Понимание молекулярных механизмов, ответственных за митогенную активность трансформированных клеток, открывает новые пути контроля опухолевого роста. Одним из объектов, активно изучаемых в последние годы в качестве новой противоопухолевой мишени, является рецептор эпидермального фактора роста (EGFR).
EGFR - трансмембранный гликопротеин молекулярной массой 170 kD, обладающий тирозинкиназной активностью. EGFR (или HER1) относится к семейству рецепторов эпидермального фактора роста, которое также представлено другими его видами: erbB2/HER2-neu; erbB3/HER3 и erbB4/HER4.
EGFR экспрессируется на поверхности как нормальных, так и трансформированных эпителиальных клеток и участвует в регуляции клеточного роста и дифференцировки. Как и все рецепторные тирозинкиназы, EGFR состоит из трех участков: внеклеточный лиганд-связывающий домен, трансмембранный гидрофобный участок и внутриклеточный тирозинкиназный домен (рис. 1).
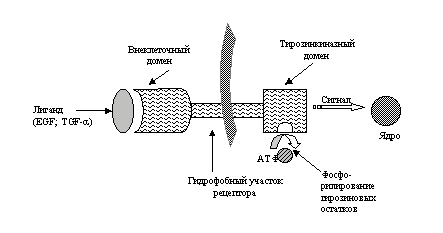
Рис. 1. Схематическое строение EGFR.
В роли лигандов выступают экскретируемые нормальными и/или опухолевыми клетками ростовые факторы EGF и TGF-a, которые аутокринным и/или паракринным путем регулируют активность рецептора эпидермального фактора роста. Активация EGFR происходит после связывания одного из специфичных лигандов с внеклеточным доменом, последовательных конформационных изменений в виде димеризации рецептора и реакции фосфорилирования тирозиновых остатков внутриклеточного домена.
На этапе взаимодействия с факторами роста существует возможность не только гомодимеризации EGFR, т.е. образования двух идентичных рецепторов EGFR связанных с общим лигандом, но может произойти и гетеродимеризация EGFR с другими представителями семейства erbB, в частности с рецептором Her2/neu и erB3. Образование гетеродимера приводит к значительному усилению внутриклеточных сигнальных импульсов.
В результате всех этих взаимодействий активированная тирозинкиназа через специальные белки запускает целый каскад внутриклеточных процессов, передающих импульс к ядру клетки и, тем самым, инициирует клеточную пролиферацию и ряд других биологических эффектов, ответственных за опухолевую прогрессию: адгезию и инвазию трансформированных клеток, включение антиапоптотических механизмов (1). Более того, TGF-a и EGF могут индуцировать процессы опухолевого ангиогенеза за счет гиперэкспрессии васкулярного эндотелиального фактора роста (VEGF) (1,2).
Таким образом, можно выделить следующие основные механизмы активации EGFR-зависимых сигнальных путей в опухолевых клетках: 1) гиперэкспрессия EGFR, 2) избыточная продукция факторов роста (TGF-a, EGF), 3) мутация EGFR и, как следствие этого, его повышенная активность при отсутствии факторов роста, 4) гетеродимеризация рецептора.
При ряде опухолей эпителиальной природы (раке легкого, яичников, толстой кишки, предстательной железы, плоскоклеточном раке головы и шеи) обнаруживается избыточная экспрессия EGFR и/или одного из его лигандов (EGF; TGF-a), что может служить причиной повышенной пролиферативной активности трансформированных клеток (3,4). Гиперэкспрессия EGFR опухолевыми клетками, как правило, ассоциируется с поздними стадиями и метастатическим фенотипом заболевания и, соответственно, коррелирует с плохим прогнозом (5).
Таблица 1.
Экспрессия EGFR различными видами опухолей.
| Тип опухоли | Частота экспрессии EGFR |
|---|---|
| Немелкоклеточный рак легкого | 40%-80% |
| Рак толстой кишки | 25%-77% |
| Рак желудка | 33% |
| Рак яичников | 35%-70% |
| Рак молочной железы | 15%-30% |
| Рак предстательной железы | 40% |
В итоге, выбор EGFR в качестве противоопухолевой мишени выглядит вполне обоснованным и логичным. Помимо этого, результаты экспериментальных исследований указывают на возможность усиления цитотоксического действия других противоопухолевых агентов: платиновых производных, доксорубицина, гемцитабина и таксанов при сочетании последних с ингибиторами EGFR (6,7,8). Интересно, что наблюдаемый в этих случаях противоопухолевый синергизм не требует повышенного уровня экспрессия EGFR.
В самом деле, механизмы действия цитотоксических препаратов и EGFR ингибиторов кардинально отличаются, и идея их совместного использования крайне привлекательна. С одной стороны, цитотоксический эффект позволяет добиться максимальной циторедукции, т.е. уменьшения объема опухолевой массы, с другой - дополнительное цитостатическое антипролиферативное воздействие обеспечивает продолжительное сохранение достигнутого эффекта или стабилизации.
Представляется также, что эффективность терапии ингибиторами EGFR должна оцениваться в большей степени с точки зрения отдаленных, чем непосредственных результатов лечения.
Существует несколько возможностей блокирования реализуемого через EGFR биологического эффекта:
На протяжении последних 15 лет все эти подходы интенсивно разрабатываются в эксперименте с целью поиска новых потенциальных противоопухолевых агентов и внедрения их в клиническую практику. Результатом этого поиска явился синтез таких препаратов как цетуксимаб (С225), иресса (ZD1839) и OSI-774, которые активно изучаются уже в рамках II и III фаз клинических исследований.
Цетуксимаб (С225) представляет собой рекомбинантое химерное моноклональное антитело, обладающее высокой специфичностью к внеклеточному домену EGFR и, соответственно, способное конкурировать с естественными лигандами (EGF; TGF-a) за связывание с рецептором. Препарат синтезирован на основе мышиного моноклонального антитела М225, к которому для снижения иммуногенности присоединили фрагмент человеческого IgG1.
Результаты клинических исследований, проведенных в рамках I фазы и представленных в 2000 г. на ASCO, выглядят многообещающими (таблица 2). Дизайн этих исследований был нацелен на изучение переносимости препарата, фармакокинетических параметров и поиск оптимальной дозы цетуксимаба. Одним из критериев включения являлось наличие гиперэкспрессии EGFR опухолевой тканью, определяемой иммуногистохимическим методом на парафиновых блоках.
Jose Baselga изучил возможность использования С225 как в монорежиме, так и в комбинации с цисплатином у 52 пациентов с зарегистрированным прогрессированием болезни после химиотерапии первой линии (9). В результате 30 больных получили С225 в монорежиме с эскалацией дозы от 50 мг/м2 до 400 мг/м2 1 раз в неделю на протяжении 12 недель и 22 пациента - комбинацию С225 и цисплатина в дозе 60 мг/м2.
И хотя максимальная переносимая доза так и не была достигнута, динамика клиренса препарата в сыворотке крови позволяла предполагать, что оптимальная насыщающая доза С225 варьирует от 200 мг/м2 до 400 мг/м2. Цисплатин не влиял на фармакокинетику препарата. У 2 пациентов с опухолевым поражением головы и шеи, получавших С225 в дозе 200 мг/м2 и 400 мг/м2 в комбинации с цисплатином зарегистрированы частичные ремиссии.
Токсичность терапии была незначительной и в основном проявлялась в виде лихорадки, астении, повышении уровня трансаминаз и кожных реакций (угревидной сыпи). За исключением кожной, другие виды токсичности не зависели от разовой и/или суммарной дозы С225. Всего у одного больного на фоне терапии выявлено повышение титра анти-С225 антител.
Таблица 2.
Результаты I фазы клинических исследований по изучению цетуксимаба.
| Автор | Число б-ных | Вид опухоли | Схема лечения | Результаты |
|---|---|---|---|---|
| Baselga et al. (9) | 52 | Рак легкого, головы и шеи, яичников, почки и др. |
С225 5-400 мг/м2, 1 раз в нед.+цисплатин | Минимальная токсичность, 2 частичные ремиссии |
| Rubin et al. (10) | 8 | Рак легкого, толстой кишки, головы и шеи |
С225 100-500 мг/м2, 1раз в нед. +цисплатин+ СРТ11 | 7 объективных эффектов |
| Mendelsohn et al. (11) | 11 | Рецидив рака головы и шеи после х/т циспла- тином |
С225+Цисплатин | 1 полная и 3 частичные ремиссии |
Rubin et al. (10) на небольшой группе больных (8 чел.), ранее уже получавших противоопухолевую лекарственную и/или лучевую терапию, также продемонстрировали хорошую переносимость и потенциальную эффективность комбинации С225+цисплатин и С225+иринотекан.
Вселяют оптимизм представленные в этом году результаты двух других исследований в рамках II фазы. В первом изучена комбинация С225 и гемцитабина у ранее не леченых больных раком поджелудочной железы (12). Цетуксимаб первоначально вводился в насыщающей дозе 400 мг/м2 с последующей поддерживающей дозой 250 мг/м2 1 раз в неделю в комбинации с еженедельной инфузией гемцитабина 1000 мг/м2 в течение 7 недель. Из 41 больного у 5 (12%) наблюдался частичный эффект и еще у 16 (39%) - минимальный ответ или стабилизация болезни. Время до прогрессирования составило 16 недель.
В другом более крупном исследовании показано, что простое добавление С225 в схему лечения больных колоректальным раком помогает снять рефрактерность опухоли к иринотекану, т.е. модифицировать его цитотоксическое действие (13). Причем режим введения иринотекана в случае развития резистентности авторы оставляли прежним и ограничивались лишь дополнительным назначением С225 в насыщающей дозе 400 мг/м2 с последующим еженедельным введением поддерживающей дозы 200 мг/м2. В итоге из 121 больного, включенного в это исследование, у 21 (17%) зарегистрирована частичная ремиссия продолжительностью от 1,5 до 7 месяцев и у 37 (31%) - минимальный эффект или стабилизация процесса.
Следует отметить, что в онкологической практике уже накоплен некоторый клинический опыт применения моноклональных антител. Так, за относительно короткий срок трастузумаб (Герцептин), ингибитор Erb2 рецептора, зарекомендовал себя при лечении диссеминированных форм рака молочной железы с повышенным уровнем экспрессии Her2/neu, а ритуксимаб (анти-CD20 антитела) - при лечении злокачественных В-клеточных лимфом.
Однако не меньший интерес с точки зрения практического использования вызывают препараты из группы низкомолекулярных ингибиторов тирозинкиназной активности EGFR - ZD1839 (иресса) и OSI-774. Преимущество препаратов заключается в том, что на их активность не влияет уровень секреции EGF и/или TGF-a, т.к. они не конкурирует с последними за связывание с внеклеточным доменом рецептора, а реализует свое действие уже внутри клетки блокируя фосфорилирование рецепторной тирозинкиназы.
Кроме того, благодаря своей низкой молекулярной массе препараты обладают хорошей проникающей способностью и, что не менее важно, удобны в применении, поскольку назначаются per os.
ZD1839 (Иресса). Препарат синтезирован в лаборатории компании Astra Zeneca. В ходе одного из первых клинических исследований I фазы монотерапия ZD1839 в режиме эскалации дозы от 50 до 700 мг/сутки при минимальной токсичности продемонстрировала убедительную противоопухолевую эффективность в основном у больных немелкоклеточным раком легкого, ранее леченых с помощью стандартных химиотерапевтических подходов (14). Частичные ремиссии (2-9+ мес.) отмечены у 4 (25%) из 16 пациентов и еще в 2 (12%) случаях наблюдались стабилизации (5-5+ мес.). Дозолимитирующим видом токсичности являлась диарея 3 ст., зафиксированная в 3% случаев при использовании максимальной дозы 700 мг/сутки.
Эти результаты подтверждаются данными Baselga et al. (15), которые сообщили об эффективности и хорошей переносимости Ирессы при лечении 127 больных различными видами опухолей. Максимальная переносимая доза не была достигнута. Из токсических проявлений 1-2 ст. ведущее место занимали кожные реакции (58%), диарея (44%), тошнота (25%) и рвота (22%). Всего 4 пациента были досрочно исключены из исследования в связи развившейся токсичностью 3-4 ст.: у 1 больного отмечалась кожная сыпь и у 3 - диарея, которая носила обратимый характер.
Несмотря на то, что объективного эффекта удалось добиться только у 2 пациентов (немелкоклеточный рак легкого и рак предстательной железы), частота минимальных эффектов (3 больных) и стабилизаций заболевания продолжительностью более 3 мес. (29 больных) приближалась к 41%. Минимальная доза препарата, при которой регистрировались ремиссии, составляла 150 мг/сутки. На данном этапе, ориентируясь на результаты 6 клинических исследований I фазы, в которые в общей сложности включены более 300 больных, можно сделать вывод о том, что биологически эффективная доза препарата значительно ниже максимальной переносимой дозы и колеблется от 250 мг до 500 мг.
Успешное завершение I/II фазы клинических исследований позволило инициировать рандомизированные плацебо контролируемые многоцентровые исследования в рамках III фазы по изучению роли ZD1839 в наиболее активных химиотерапевтических комбинациях (гемцитабин/цисплатин и паклитаксел/карбоплатин) у больных немелкоклеточным раком легкого. В предстоящем сравнительном анализе выживаемость больных будет являться основным показателем, определяющим эффективность того или иного лекарственного подхода.
Рассматриваются также возможности комбинированного применения герцептина и ирессы у больных раком молочной железы при одновременной экспрессии опухолью EGFR и Her2/neu, которая может встречаться в 10-36% случаев (5). Для этого подхода имеются свои предпосылки. Во-первых, доклинические исследования показывают, что трастузумаб не снимает EGF индуцированную активность рецептора эпидермального фактора роста (16), во-вторых, сочетание двух препаратов сопровождается более выраженным угнетением пролиферативной активности опухолевых клеток in vitro (17).
OSI-774 - другой низкомолекулярный ингибитор EGFR с потенциально широкими возможностями использования в клинической практике. Препарат доказал свою активность у больных плоскоклеточным раком головы/шеи и немелкоклеточным раком легкого в ходе II фазы клинических исследований. Предклинические испытания показали, что применение OSI-774 в ежедневной дозе 150 мг/сутки обеспечивает достаточную для реализации противоопухолевого эффекта концентрацию препарата в сыворотке крови.
N. Senser et al. приводят данные о 114 пациентах, получавших лечение OSI-774 в связи с рецидивом плоскоклеточного рака головы/шеи после индукционной химиотерапии первой линии (18). Как и при использовании ZD1839, наиболее часто встречаемыми токсическими осложнениями, носящими обратимый характер, являлись кожная сыпь, диарея, тошнота, рвота и слабость. Редукция дозы препарата потребовалась в 21% случаев. На данном этапе эффективность лечения оценена у 78 пациентов. Частичная ремиссия зарегистрирована у 13%, стабилизация у 29% больных. В скором времени авторы приведут данные о влиянии на результаты лечения исходного уровня экспрессии EGFR опухолевой тканью.
В другой работе неплохих результатов удалось добиться у больных с IIIB-IV стадиями немелкоклеточного рака легкого с прогрессированием и/или рецидивом болезни после проведенной химиотерапии с включением платиновых производных (19). В группе из 56 пациентов, получавших монотерапию OSI-774, у 6 (11%) больных зафиксирована частичная ремиссия и у 19 (34%) - стабилизация заболевания. Причем эффекты наблюдались вне зависимости от степени экспрессии EGFR опухолью и регистрировались также при низких значениях этого показателя.
Суммируя все вышеизложенное, можно констатировать, что постепенно с развитием фундаментальной науки открываются новые перспективы лекарственного лечения злокачественных новообразований. Регулирование активности EGFR - это только один из многих принципиально новых механизмов противоопухолевого контроля, которые успешно пробивают себе дорогу в клиническую практику.
Список литературы: