
2-6 июня 2006 года, Атланта, США
Трякин А.А.
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Не смотря на то, что, как обычно, подавляющее число докладов в данном разделе было посвящено раку предстательной железы, наиболее интересные публикации, на мой взгляд, касались рака почки и герминогенных опухолей.
Рак почки
На протяжении последних 30 лет стандартной и, практически, единственной терапией метастатического рака почки была иммунотерапия (интерфероны и интерлейкин-2). Успехи ее были более чем скромные: частота объективных ответов не превышала 20%, а медиана общей выживаемости - одного года.
В 2003г бевацизумаб - моноклональное антитело к фактору роста эндотелия сосудов (VEGF) продемонстрировал достоверное увеличение времени до прогрессирования в сравнении с плацебо у больных с метастатическим раком почки [1].
Другим путем воздействия на опухолевый неоангиогенез является блокирование тирозинкиназ рецепторов VEGF, которые передают стимулирующие сигналы с рецептора в ядро клетки. Одним из первых в клиническую практику вошел препарат сунитиниб (Сутент®), блокирующий тирозинкиназы рецепторов VEGF, PDGF (тромбоцитарного фактора роста) и ряда других. Ранее сунитиниб продемонстрировал необычайно высокую для рака почки частоту объективных ответов – 40% во второй линии терапии. На ASCO 2006 были представлены результаты исследования III фазы, в котором 750 больных метастатическим раком почки получали сунитиниб (50 мг в сутки на протяжении 4 недель с последующим 2-недельным перерывом) или интерферон-α (по 9млн. МЕ 3 раза в неделю) [2]. Основной задачей было увеличение времени до прогрессирования заболевания (progression free survival – PFS). Сунитиниб подтвердил свою значительную активность: в сравнении с иммунотерапией частота объективного ответа достоверно выросла с 5% до 25%, а медиана PFS – c 5,8 мес. до 11 мес., что соответствует снижению риска прогрессирования заболевания на 61%. Хочется надеяться, что улучшение общей выживаемости будет столь же впечатляющим. С января 2006г сунитиниб одобрен Food and Drug Administration (FDA) в США для лечения метастатического рака почки и гастроинтестинальных стромальных опухолей (GIST) после прогрессирования на иматинибе (Гливек®).
На сегодняшний день единственным препаратом, показавшим преимущество перед интерферонами в первой линии терапии, является темзиролимус (CCI-779). В основе механизма его действия лежит блокада белка m-TOR, участвующего во многих клеточных процессах, в том числе и ангиогенезе. В большом исследовании, включавшем свыше 600 больных плохой прогностической группы (прогностическая модель Motzer`a), было 3 «рукава»: монотерапия интерфероном-α, темзиролимус (по 25 мг в/в еженедельно) и комбинация обоих препаратов [3]. Медиана продолжительности жизни составила 7,3 мес., 10,9 мес. (HR 0.73, 95%CI 0.57-0.92, p=0,007) и 8,4 мес. соответственно. Эффективность комбинированного режима не отличалась от монотерапии интерфероном.
Новые «целевые» препараты активно завоевывают свои позиции не только в первой линии терапии метастатического рака почки, но и после прогрессирования на интерферонах. В 2005г на конференции ЕССО были доложены результаты двойного слепого рандомизированного исследования, в котором сорафениб (ингибитор многих тирозинкиназ, включая рецепторов VEGF) сравнивался с поддерживающей терапией у больных метастатическим раком почки, прогрессирующих после первой линии системной терапии [4]. Применение сорафениба позволило удвоить медиану продолжительности времени до прогрессирования с 2,8 мес. до 5,6 мес. После получения этих данных было принято решение о переводе пациентов, получающих плацебо, на сорафениб (crossover). На ASCO 2006 были представлены результаты, касающиеся общей выживаемости, которую удалось улучшить с 14,3 (поддерживающая терапия) до 19,3 мес. (группа сорафениба) (HR = 0.74, 95% CI 0.58-0.93; p = 0.01) [5].
Таблица 1.
ASCO 2006: исследования III фазы, посвященные метастатическому раку почки.
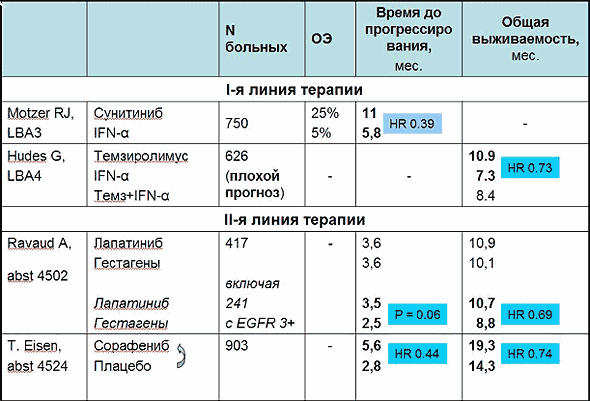
Другой интересной мишенью для целевых препаратов являются рецепторы эпидермального фактора роста (EGFR). Ингибиторы тирозинкиназ EGFR1 вошли в клиническую практику при лечении немелкоклеточного рака легкого, антитела к EGFR2 (HER-2/neu) – трастузумаб – молочной железы. Лапатиниб представляет собой двойной ингибитор тирозинкиназ (EGFR1 и 2) и был тестирован во второй линии терапии рака почки. В рандомизированном исследовании III фазы, включавшем 417 пациентов, лапатиниб не улучшил результаты терапии прогестинами – медиана времени до прогрессирования составила 3,6 мес. в обеих группах [6]. Тем не менее, препарат оказался более эффективным у больных с гиперэкспрессией EGFR1 (общая выживаемость 10,7 мес. и 8,8 мес., р=0,02, соответственно). Данное исследование еще раз продемонстрировало важность правильного отбора больных для лечения целевыми препаратами, который должен основываться на молекулярно-биологических свойствах опухоли.
Герминогенные опухоли
Являясь редкой и высоко курабельной опухолью, герминогенные опухоли не привлекают интереса фармацевтических компаний, что затрудняет проведение больших исследований в этой области. Не смотря на это, на ASCO 2006 прозвучало несколько важных и интересных сообщений. Одним из них, вызвавшим большую дискуссию, явилось рандомизированное исследование из Германии, посвященное адъювантной терапии при I стадии (опухоль ограничена только яичком) несеминомных герминогенных опухолей.
Как известно, существует три возможных опции для этих пациентов: 2 курса адъювантной химиотерапии по программе ВЕР, профилактическая нерво-сберегающая забрюшинная лимфаденэктомия (НЗ-ЗЛАЭ) и динамическое наблюдение. Недостатком химиотерапии является то, что, даже в группе высокого риска рецидива (инвазия опухоли в сосуды), около половины больных получают ее напрасно. А это приводит, в свою очередь, к поздней токсичности (поражение почек, нарушение фертильности, повышение риска возникновения злокачественных опухолей). В германском исследовании была предпринята попытка уменьшить объем адъювантной химиотерапии до одного курса ВЕР [7]. В качестве контроля выполнялась НЗ-ЗЛАЭ. В случае обнаружения метастазов в забрюшинных лимфоузлах (pII стадия), больным профилактически проводилось 2 курса химиотерапии по схеме ВЕР. 366 пациентов приняло участие в исследовании, медиана наблюдения за ними составила 50 мес. Частота рецидивов заболевания была значительно ниже в группе химиотерапии (1,1%), чем в группе ЗЛАЭ (7,5%). Все эти рецидивы были в дальнейшем успешно вылечены. Формально можно сделать вывод, что один курс ВЕР лучше профилактической НЗ-ЗЛАЭ. Однако данное исследование было подвергнуто серьезной критике. Во-первых, не проанализирована эффективность одного курса ВЕР в группе больных с высоким риском. Не смотря на то, что последних было 44%, у исследования нет достаточной статистической силы, чтобы делать выводы по подгрупповому анализу. Во-вторых, в группе НЗ-ЗЛАЭ оказался необычно высокий процент рецидивов в забрюшинном пространстве (36% от всех рецидивов). Это объясняется тем, что большая часть больных оперировалась в урологических стационарах общего профиля. И, в-третьих, отсутствуют данные по токсичности лечения и качеству жизни больных.
Поэтому стандартной опцией для больных с несеминомой I стадии остается динамическое наблюдение. Лишь в случае невозможности организации должного наблюдения за такими пациентами (отдаленное место жительства, характерологические особенности), показано проведение 1 курса химиотерапии по программе ВЕР. Для больных же с наличием опухолевой инвазии в сосуды стандартом остаются 2 курса ВЕР.
Метастатические герминогенные опухоли
В соответствие с классификацией IGCCCG выделяют три прогностических группы больных с метастатическими герминогенными опухолями. Длительная выживаемость варьирует от 95% в группе хорошего прогноза до 48% в группе плохого. Стандартной терапией больных с плохим прогнозом остается комбинация ВЕР (4 курса). Одним из возможных путей улучшения результатов лечения является высокодозная химиотерапия (ВДХТ) с реинфузией клеток, предшественников кроветворения. В исследованиях II фазы были получены обнадеживающие результаты использования ВДХТ как при лечении рецидивов заболевания, так и в первой линии.
В этом году на ASCO были представлены результаты долгожданного рандомизированного исследования III фазы, напрямую сравнившего ВДХТ со стандартной терапией ВЕР [8]. В экспериментальной группе больные получали 2 курса ВЕР с последующими двумя курсами ВДХТ комбинацией карбоплатин, этопозид и циклофосфамид. К сожале-нию, ВДХТ не привела к улучшению результатов лечения: время до прогрессирования и общая выживаемость оказались одинаковы в обеих группах. Другой задачей исследования была оценка прогностического значения скорости снижения опухолевых маркеров (АФП и ХГ) на протяжении первых двух курсов химиотерапии. Медленное снижение ассоциировалось с ухудшением общей 2-летней выживаемости по сравнению с нормальной скоростью – 68% и 83% (р=0,03) соответственно. Анализ показал, что от проведения ВДХТ выигрывали лишь пациенты с медленной скоростью снижения маркеров. Этот факт, конечно же, требует дальнейшего изучения. На сегодняшний день проведение в первой линии ВДХТ не может быть рекомендовано в повседневной практике. Четыре курса ВЕР остаются стандартным индукционным режимом для больных с промежуточным и плохим прогнозом.
Рак предстательной железы
На протяжении нескольких десятилетий лучевая терапия остается высокоэффективным методом лечения локальных форм рака предстательной железы. Не смотря на проведенное большое число исследований, все еще не определена роль адъювантной гормонотерапии после лучевой терапии. Итальянские ученые выполнили совместный анализ 6 рандомизированных исследований, посвященных этому вопросу [9]. Комбинированное лечение приводило к достоверному абсолютному снижению частоты рецидивов заболевания на 10,7% (р<0,00001). Также наблюдалась тенденция к улучшению общей выживаемости (относительный риск 0.90, 95% ДИ 0.75-1.10, p = 0.263), не достигшая, однако, статистической достоверности.
Если вопрос о применении гормонотерапии в лечении локальных форм еще остается открытым, то у ее ведущая роль в лечении местно-распространенного и метастатического рака не вызывает сомнений. Применение антиандрогенов, агонистов LHRH и их комбинации (максимальная андрогенная блокада – МАБ) позволяет достичь эффекта у порядка 80% больных. Классически гормонотерапия проводится непрерывно до признаков прогрессирования заболевания. Альтернативой непрерывной терапии является прерывистая гормонотерапия, возобновляемая при росте ПСА. Данный подход позволяет существенно снизить частоту побочных эффектов лечения, в том числе и импотенцию. Южно-европейская онкоурологическая группа представила в этом году на ASCO результаты большого рандомизированного исследования, сравнившего непрерывную МАБ с прерывистой [10]. 766 больных с метастатическим или местно-распространенным раком предстательной железы получали в течение 3 месяцев МАБ. Те, у которых был зарегистрирован эффект (снижение уровня ПСА на >80% от исходного или < 4нг/мл) (n=626), были рандомизированы на непрерывную или прерывистую МАБ (ципротерон + декаптил). При среднем сроке наблюдения за больными 51 мес. частота рецидивов и общая выживаемость не отличались. В экспериментальной группе половина больных была свободна от терапии на протяжении одного года, 29% - в течение 3 лет. Те же, кто достиг после начального этапа МАБ уровня ПСА < 2 нг/мл, смогли в дальнейшем провести в среднем 82% своего времени без терапии. Естественно, что качество жизни (главным образом сексуальная жизнь), было лучше при прерывистой МАБ.
Другим побочным эффектом агонистов LHRH является остеопороз. В рандомизированном исследовании больным неметастатическим раком предстательной железы, получавшим агонисты LHRH, назначалась золендроновая кислота (Зомета®) 4 мг однократно или плацебо [11]. Через год у больных, получивших Зомету, было отмечено повышение плотности костной ткани на 4.0 ± 0.9% по сравнению с началом терапии. В то же время наблюдалось снижение ее плотности на 3.1 ± 0.9% у пациентов из группы плацебо (p<0,001 при межгрупповом сравнении). Таким образом, ежегодное введение Зометы является удобным и недорогим методом профилактики остеопороза у больных, получающим агонисты LHRH.
Другой подход к профилактике остеопороза у данной категории больных представили M. Smith c соавт. [12] Для борьбы остеопорозом они назначали антиэстроген торемифен. Промежуточный анализ показал достоверное увеличение плотности костной ткани в группе торемифена, по сравнению с плацебо. Исследование продолжается.
Гормонорефрактерный рак предстательной железы
Не смотря на первоначальный ответ диссеминированного рака предстательной железы на гормонотерапию, у большинства больных со временем развивается резистентность к проводимому лечению. В лабораторных и клинических работах было показано ингибирующее влияние аналогов соматостатина на рост рака простаты. В небольшом рандомизированном исследовании II фазы 72 пациентам с гормонорефрактерным метастатическим процессом назначался декаптил + преднизолон ± соматулин (аналог соматостатина, 120 мг каждые 4 недели) [13]. Токсичность обоих режимов была минимальной. Добавление соматулина привело к существенному увеличению времени до прогрессирования по ПСА (5,8 мес.) в сравнении со стандартной терапией (1,8 мес.). Для анализа общей выживаемости необходим больший срок наблюдения.
Литература
1. Yang JC, Haworth L, Sherry RM, et al. A randomized trial of bevacizumab, an anti-vascular endothelial growth factor antibody, for metastatic renal cancer. N Engl J Med. 2003 Jul 31;349(5):427-34.
2. R. J. Motzer, T. E. Hutson, P. Tomczak, et al. Phase III randomized trial of sunitinib malate (SU11248) versus interferon-alfa (IFN-α) as first-line systemic therapy for patients with metastatic renal cell carcinoma (mRCC). 2006 ASCO Annual Meeting Proceedings, 24(18S): LBA3.
3. G. Hudes, M. Carducci, P. Tomczak, et al. A phase 3, randomized, 3-arm study of temsirolimus (TEMSR) or interferon-alpha (IFN) or the combination of TEMSR + IFN in the treatment of first-line, poor-risk patients with advanced renal cell carcinoma (adv RCC). J ClinOncol, 2006 ASCO Annual Meeting Proceedings, 24(18S): LBA4.
4. B. Escudier, C. Szczylik, T. Eisen et al. Randomized phase III trial of the multi-kinase inhibitor sorafenib (BAY-43-9006) in patients with advanced renal carcinoma (RCC). Europ J Cancer 2005, 3(2); p226.
5. Eisen, R. M. Bukowski, M. Staehler, et al. Randomized phase III trial of sorafenib in advanced renal cell carcinoma (RCC): Impact of crossover on survival. J ClinOncol, 2006 ASCO Annual Meeting Proceedings, 24(18S): 4524.
6. A. Ravaud, J. Gardner, R. Hawkins, et al. Efficacy of lapatinib in patients with high tumor EGFR expression: Results of a phase III trial in advanced renal cell carcinoma (RCC). J ClinOncol, 2006 ASCO Annual Meeting Proceedings, 24(18S): 4502.
7. P. Albers, R. Siener, S. Krege, et al. One course of adjuvant PEB chemotherapy versus retroperitoneal lymph node dissection in patients with stage I non-seminomatous germ-cell tumors (NSGCT): Results of the German Prospective Multicenter Trial (Association of Urological Oncology [AUO]/German testicular cancer study group [GTCSG] Trial 01-94). J ClinOncol, 2006 ASCO Annual Meeting Proceedings, 24(18S): 4512.
8. D. F. Bajorin, C. R. Nichols, K. A. Margolin, et al. Phase III trial of conventional-dose chemotherapy alone or with high-dose chemotherapy for metastatic germ cell tumors (GCT) patients (PTS): A cooperative group trial by Memorial Sloan-Kettering Cancer Center, ECOG, SWOG, and CALGB. J Clin Oncol, 2006 ASCO Annual Meeting Proceedings, 24(18S): 4510.
9. P. Carlini, E. Bria, M. Ciccarese, et al. Hormonal adjuvant treatment plus radiotherapy versus exclusive radiotherapy in locally advanced prostate cancer: Pooled analsys of 6 randomized trials. J Clin Oncol, 2006 ASCO Annual Meeting Proceedings, 24(18S): 4642.
10. F. M. Calais Da Silva, F. Calais Da Silva, A. Bono, et al. Phase III intermittent MAB vs continuous MAB. J Clin Oncol, 2006 ASCO Annual Meeting Proceedings, 24(18S): 4513.
11. D. Michaelson, H. Lee, D. S. Kaufman, et al. Annual zoledronic acid to prevent gonadotropin-releasing hormone agonist-induced bone loss in men with prostate cancer: A randomized placebo-controlled trial. J Clin Oncol, 2006 ASCO Annual Meeting Proceedings, 24(18S): 4515.
12. M. R. Smith, F. Chu, J. Forrest, et al. Toremifene citrate increases bone mineral density in men receiving androgen deprivation therapy for prostate cancer. J Clin Oncol, 2006 ASCO Annual Meeting Proceedings, 24(18S): 4553.
13. F. Silva, F. M. Calais Da Silva, F. Goncalves, T. Oliver. Phase II screening study to assess the combination of a LHRH analogue, dexamethasone and a somatostatin analogue versus a LHRH analogue with dexamethasone in hormone refractory prostate cancer patients. J Clin Oncol, 2006 ASCO Annual Meeting Proceedings, 24(18S): 4565.