Новости онкологии Прочти об этом раньше, чем твой пациент
12.03.2024
Новым вектором развития комбинированного лечения местнораспространенного рака пищевода становится изучение возможностей предоперационной химиоиммунной терапии. В январе 2024 года на ASCO GI были опубликованы первые результаты рандомизированного исследования III фазы ESCORT-NEO [1], включившего 391 пациента с резектабельным (T1b-3N1-3M0 или T3N0M0) плоскоклеточным раком пищевода. Дизайн работы предполагал проведение 2 курсов неоадъювантной терапии (1 раз в 3 недели) с последующей операцией через 4-6 недель после окончания предоперационного лечения. Больные рандомизировались в 3 группы: камрелизумаб + наб-паклитаксел + цисплатин (группа А, n=132), камрелизумаб + паклитаксел + цисплатин (группа B, n=130) и паклитаксел + цисплатин (группа C, n=129). При этом в группах A и B после операции продолжалась иммунотерапия камрелизумабом до 15 курсов, а в качестве первичных конечных точек исследования были выбраны частота полных патоморфологических ответов (pCR) и показатель бессобытийной выживаемости (Event-free survival, EFS). Выборка в данной работе состояла преимущественно из пациентов с III ст. заболевания (71,4%) и локализацией опухоли в средне-грудном (51,4%) и нижне-грудном (38,1%) отделах пищевода.
Анализ популяции Intention-to-Treat показал, что частота pCR составила 28,0% (группа A), 15,4% (группа B) и 4,7% (группа C). Прямое сравнение групп между собой также подтвердило достоверность полученных данных: при сравнении групп A и C отношение рисков (ОР) составило 8,11 (95% ДИ 3,28-20,06, двусторонний p<0,0001); при сравнении групп B и С ОР составило 3,81 (95% ДИ 1,48-9,80, двусторонний p=0,0034). Добавление иммунотерапии к платиносодержащей химиотерапии также приводило к увеличению частоты больших патоморфологических ответов (59,1%, 36,2% и 20,9% в группах A, B и C) и R0-резекций (99,1%, 95,7% и 92,2%). Новый подход не оказывал достоверного влияния на риск послеоперационных осложнений любой степени (34,2%, 38,8% и 32,0%), однако несколько увеличивал частоту нежелательных явлений (НЯ) ≥3 ст. (34,1%, 28,5% и 28,8%). Данные по влиянию химиоиммунной терапии на показатели выживаемости на данный момент представлены не были.
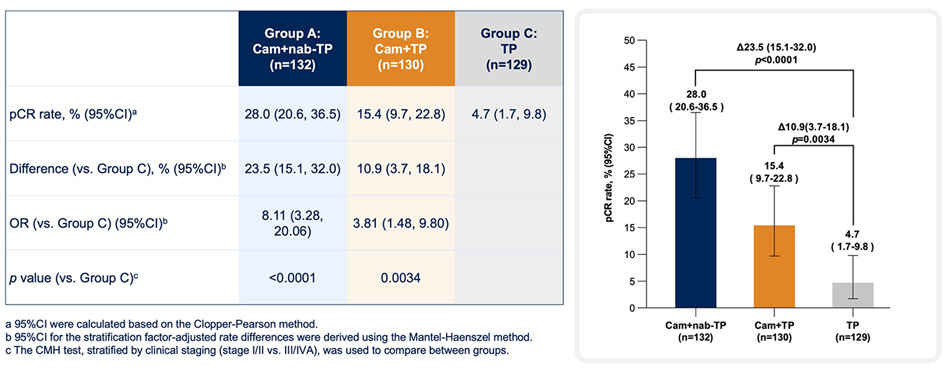
Рисунок 1. Частота полных патоморфологических ответов
Исследование было положительно встречено сообществом и сопровождалось активным обсуждением дальнейших перспектив подобного подхода. Рядом экспертов высказывалось предложение о присвоении ему в будущем статуса «нового золотого стандарта» при достижении первичной конечной точки по улучшению EFS. Однако здесь стоит вспомнить результаты исследований NExT [2] и CROSS [3]. В вышеуказанных работах проведение 3 курсов ХТ по схеме DCF или одномоментная химиолучевая терапия (паклитаксел + карбоплатин в течение 5 недель, ЛТ СОД 41,4 Гр) также ассоциировалось с увеличением частоты полных патоморфологических ответов. При этом частота pCR составляла 19,8% (NExT) и 29% (CROSS), что соотносится с результатами ESCORT-NEO. Более того, некоторыми авторами приводятся данные по отсутствию корреляции между показателем pCR и отдаленными результатами лечения плоскоклеточного рака пищевода [4], что делает предположения о «новом стандарте лечения» лишь на основании улучшения частоты полных патоморфологических ответов несколько преждевременными. Не меньше вопросов вызывает влияние экспрессии PD-L1 на эффективность лечения (будет ли она работать при CPS<5%) и целесообразность продолжения иммунотерапии в адъювантном режиме (всем больным или только при неполном патоморфозе). Тем не менее, учитывая результаты аналогичных исследований из других областей онкологии, данный подход имеет все шансы пополнить арсенал возможных лечебных опций.
Источники:
Материал подготовил И.М. Боровков